Alimentation, santé globale Temps de lecture 4 min
Les organoïdes : des organes miniatures aujourd’hui incontournables pour la biologie et la médecine
Publié le 31 octobre 2018 (mis à jour : 08 février 2022)
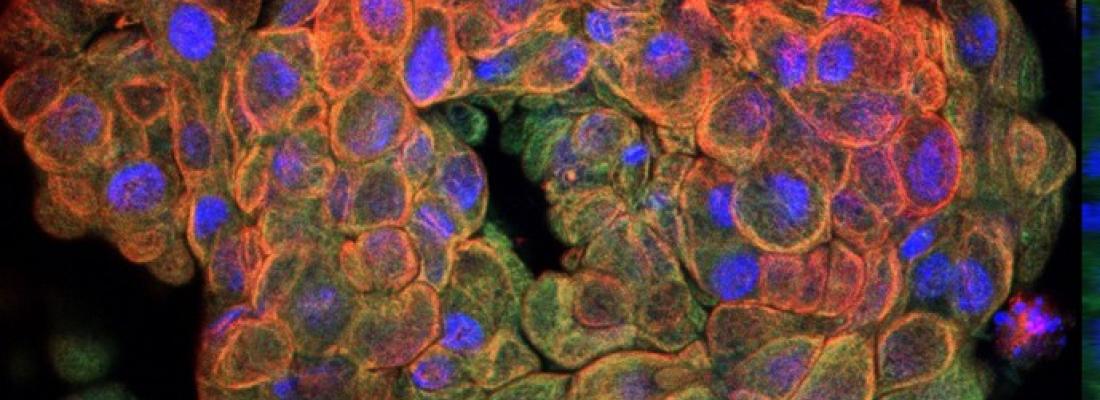
Entre l’animal entier et les lignées cellulaires en culture, les biologistes développent actuellement un modèle intermédiaire : les organoïdes. Ce sont des structures cellulaires en trois dimensions qui miment l’architecture et le fonctionnement de l’organe entier. Les organoïdes sont obtenus à partir de cellules souches grâce à un processus d’auto-organisation, favorisé par un milieu de culture contenant les facteurs de croissance et de différenciation adéquats1. Les méthodologies développées depuis les années 2010 permettent actuellement d’obtenir des organoïdes de plusieurs organes : intestin, rétine, glande mammaire, foie, rein, poumon et même cerveau. Initialement mis au point chez l’homme et la souris, ces techniques ont récemment été adaptées à de nombreuses espèces d’animaux domestiques (porc, poulet, cheval, mouton, vache, lapin).
Les organoïdes : un énorme potentiel en biologie et en médecine
Les organoïdes donnent lieu à de nombreuses applications : étude du développement, de mécanismes cellulaires, de pathologies, effets de nutriments, criblage et toxicité de médicaments etc. Leur enjeu en médecine est considérable : source de cellules et de tissus pour les greffes et la thérapie cellulaire, modèle d’organes pour tester des traitements, modélisation de différentes neuropathologies (Parkinson, Alzheimer, etc.) dans des organoïdes de cerveaux, modélisation des maladies infectieuses et test d’antimicrobiens, etc. Avec ces modèles, on peut aussi étudier la surexpression ou l’inhibition de gènes beaucoup plus facilement qu’in vivo. On peut par exemple, en inactivant un gène connu, mimer un intestin atteint de mucoviscidose et utiliser ce modèle de maladie pour tester des médicaments.
Réduire les expériences sur l’animal
Les organoïdes constituent une branche de la biologie cellulaire en plein essor. Il subsiste encore de nombreuses difficultés méthodologiques pour les obtenir et pour tester leur « conformité » avec l’organe étudié. Néanmoins, leurs modalités de culture ne cessent de se perfectionner, avec des composants et des milieux de culture de plus en plus performants. Les interactions avec les biophysiciens doivent se renforcer pour mettre au point des matrices qui guident les cellules et les aident à reproduire la forme de l’organe, comme par exemple les villosités intestinales. « Les organoïdes obtenus sont encore imparfaits, mais ils ont un potentiel énorme. Ils permettent aussi de réduire le recours aux animaux, et, bien qu’ils ne puissent pas les remplacer pour reproduire le fonctionnement de l’organisme entier, ils permettent de faire des essais préalables et de diminuer le nombre d’expériences in vivo » analyse Bertrand Pain, chercheurs au sein du Stem Cell and Brain Research Institute à Lyon .
La dynamique du collectif
Les organoïdes sont des structures qui peuvent se conserver par cryogénie, de même que les cellules souches qui servent de point de départ. Constituer des biobanques présente l’avantage d’avoir un matériel homogène pour la reproductibilité des expériences, de limiter le temps de préparation des organoïdes, de réduire les prélèvements de cellules souches sur les animaux. Pour les animaux d’intérêt agronomique, le CRB-Anim permettra le stockage et la mise à disposition de l’ensemble de la communauté scientifique, ainsi que la mutualisation des savoir-faire et du matériel produit.
Plus de 80 chercheurs de plusieurs départements scientifiques d’INRAE (PHASE, GA, SA, ALIMH et MICA) se sont regroupés au sein d’un collectif. Ce groupe de travail organise la veille scientifique et la diffusion des avancées réalisées dans le domaine des organoïdes chez les espèces agronomiques (protocoles expérimentaux, revues scientifiques, organisation de séminaires). Les membres du groupe participent également activement à une structure nationale récemment créée en Janvier 2021, le GDR Organoides.
- Les cellules souches peuvent être obtenues à partir d’un embryon, à partir d’un tissu ou par reprogrammation somatique.
L’intestin, un « bon client » pour l’obtention d’organoïdes
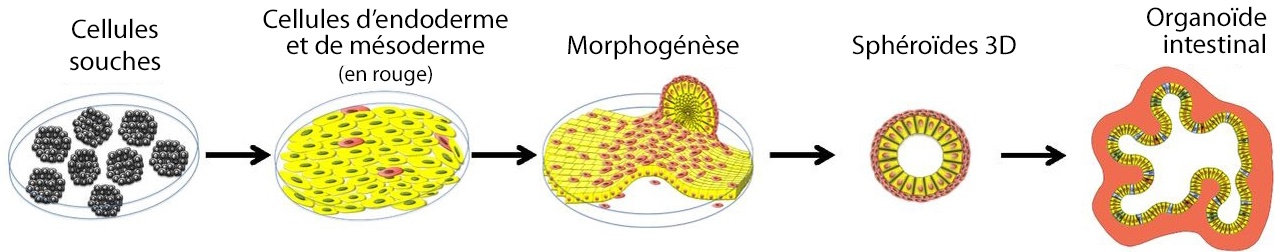
Légende : Obtention d’organoïdes d’intestin. Adapté avec la permission de JM Wells and JR Spence, 2014. Development 141, page 752, https://dx.doi.org/10.1242/dev.097386
« La qualité des cellules souches de départ est déterminante, explique Bertrand Pain (1). Ça marche d’autant mieux quand il s’agit d’organes dynamiques qui se renouvellent rapidement. C’est particulièrement le cas pour l’intestin qui se régénère entièrement tous les 4-5 jours et qui contient de nombreuses cellules souches ». En partant de ces cellules souches, on obtient des sortes de sphéroïdes comportant les cinq types cellulaires de l’intestin (2), organisées de manière polarisée, comme dans l’intestin.
En 2020, une équipe INRAE de Toulouse (3) a obtenu pour la première fois chez le lapin des organoïdes d’intestin (caecum) qui comportent tous les types cellulaires de l’épithélium (4). Ces organoïdes ont été utilisés pour mettre en évidence les effets de métabolites produits par le microbiote intestinal au moment du sevrage (5).
Par ailleurs, des expériences sur des organoïdes d’intestin de porc (jéjunum) ont permis de décrire les effets de nutriments (acides aminés et polyphénols) sur la barrière épithéliale (6).
(1) USC SBRI Stem Cell and Brain Research Institute, centre INRAE Lyon-Grenoble-Auvergne-Rhône-Alpes. (2) Entérocytes, cellules entéro-endocrines, cellules à mucus, cellule de Paneth (productrices de facteurs anti-microbiens), cellules Tuft (ayant un rôle dans l’immunité). (3) UMR GenPhySE Génétique Physiologie et Systèmes d'Elevage. Contact: martin.beaumont@inrae.fr, Centre INRAE Occitanie-Toulouse. (4) Référence : Mussard E. et al. 2020. Stem Cell Research 48, 101980. https://doi.org/10.1016/j.scr.2020.101980 (5) Référence : Beaumont M. et al. 2020. Gut Microbes 11:5, 1268-1286, DOI: 10.1080/19490976.2020.1747335 (6) Référence : Beaumont M. et al. 2021. Amino Acids. https://doi.org/10.1007/s00726-021-03082-9
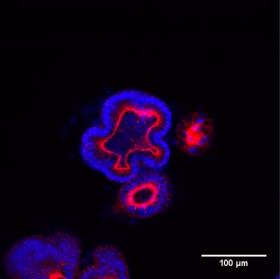
Des organoïdes pulmonaires de plusieurs espèces pour étudier les infections respiratoires
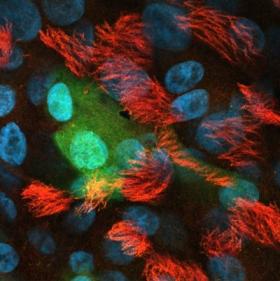
Légende : A gauche : Organoïdes de bovin composés de cellules ciliées, basales et pneumocytes de type I et II. A droite : Infection de cellules ciliées humaines dérivées d’organoïdes (les cils sont en rouge) par le virus SARS-COV2 (cellules en vert). Les noyaux sont en bleu. A. Erny et F. Archer.
Les équipes d’INRAE (1) développent depuis plusieurs années des organoïdes pulmonaires de différentes espèces de mammifères. Ces organoïdes simulent de multiples aspects de l'organe réel (activité des cils, production de mucus), ce qui en fait des modèles très utiles pour étudier les maladies pulmonaires et tester des approches thérapeutiques antivirales ou antimicrobiennes. Il est nécessaire de développer ces modèles pour chaque espèce d’intérêt, compte tenu des nombreuses différences existant entre espèces concernant le développement et la maturation du poumon, les types cellulaires et les différences de susceptibilité à un même pathogène (barrières d'espèces pour les maladies infectieuses) (2).
(1) UMR IVPC Infections virales et pathologie comparée, en collaboration avec d’autres unités d’INRAE (ISP, VIM, CSC) et d’autres partenaires (LBTI, ANSES). Contact : fabienne.archer@inrae.fr, Centre INRAE Lyon-Grenoble-Auvergne-Rhône-Alpes. (2) Revue : Archer F. et al. 2021. Vet Res 52, 77. https://doi.org/10.1186/s13567-021-00946-6
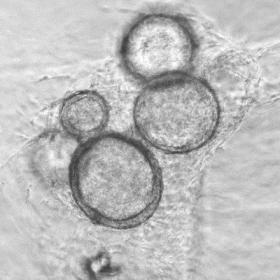
Des prémices d’alvéoles mammaires
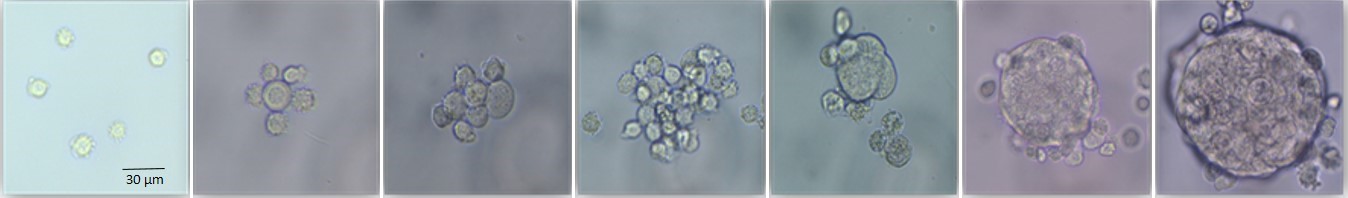
Légende : Formation d’une mammosphère en culture in vitro (microscopie optique) à partir de cellules épithéliales bovines en culture et de matrices extracellulaires ou de plastique hydrophobe. L. Finot.
Une équipe d’INRAE de Rennes (1) a testé les conditions favorables pour obtenir des mammosphères, prémices d’alvéoles mammaires, afin d’étudier la biologie de la glande mammaire. Ces travaux sont à ce jour les plus avancés dans le domaine des organoïdes mammaires, qui en sont encore à leurs balbutiements.
(1) UMR PEGASE Physiologie, Environnement et Génétique pour l'Animal et les Systèmes d'Elevage. Contact : eric.chanat@inrae.fr, laurence.finot@inrae.fr, Centre INRAE Bretagne-Normandie. (2) Référence : Finot L. et al. 2021. Vet Res. 52 (1), 1-10. doi: 10.1186/s13567-021-00947-5
Voir aussi la page : INRAE, Institut responsable en matière d’expérimentation animale
