Dossier revue
Changement climatique et risquesHomme, animal, environnement : une seule santé
Publié le 03 juillet 2024

Inde, 1994. Le diclofénac, un antidouleur, voit son prix chuter avec l’expiration de son brevet et l’arrivée de génériques. Les éleveurs indiens l’utilisent dès lors en masse pour soigner les blessures et inflammations de leurs animaux. À la fin des années 1990, les ornithologues observent une hécatombe sans précédent des vautours asiatiques : en quelques années, les populations de ces charognards sont passées de dizaines de millions à quelques milliers d’individus, plusieurs espèces devenant en danger critique d’extinction. Dans le même temps, l’Inde et les pays voisins font face à des problèmes sanitaires croissants, avec une augmentation des rats et des chiens errants ainsi que des baisses locales de la qualité de l’eau.
Trois évènements a priori distincts, traités à l’époque comme tels : une problématique vétérinaire, de nouvelles espèces menacées d’extinction et une question de santé publique. Il aura fallu attendre une décennie pour qu’un lien de causalité soit établi. Les vautours étaient en réalité empoisonnés par le diclofénac présent dans les carcasses de bétail consommées. Or, ces oiseaux tiennent un rôle écologique crucial en faisant office de cul-de-sac épidémiologique : leur système digestif particulièrement acide détruit la plupart des agents pathogènes. Une fois ces vautours disparus, ils laissèrent la place à d’autres charognards, rats et chiens errants, bien moins efficaces et vecteurs de plusieurs agents pathogènes à l’origine de maladies comme la rage. Une étude parue en janvier 20231 a ainsi estimé que les problèmes sanitaires causés par la disparition des vautours seraient à l’origine de centaines de milliers de morts en Inde. Il aurait fallu ici une compréhension globale de la situation, impliquant des écologues, épidémiologistes, vétérinaires, médecins, zoologistes et même sociologues, pour mettre en évidence, voire anticiper la cascade d’événements liés à la simple levée d’un brevet.
Émergence d’un concept
« Une seule santé » correspond à une approche intégrée de la santé humaine, animale et environnementale, trois compartiments intimement liés mais encore trop souvent étudiés et gérés indépendamment.
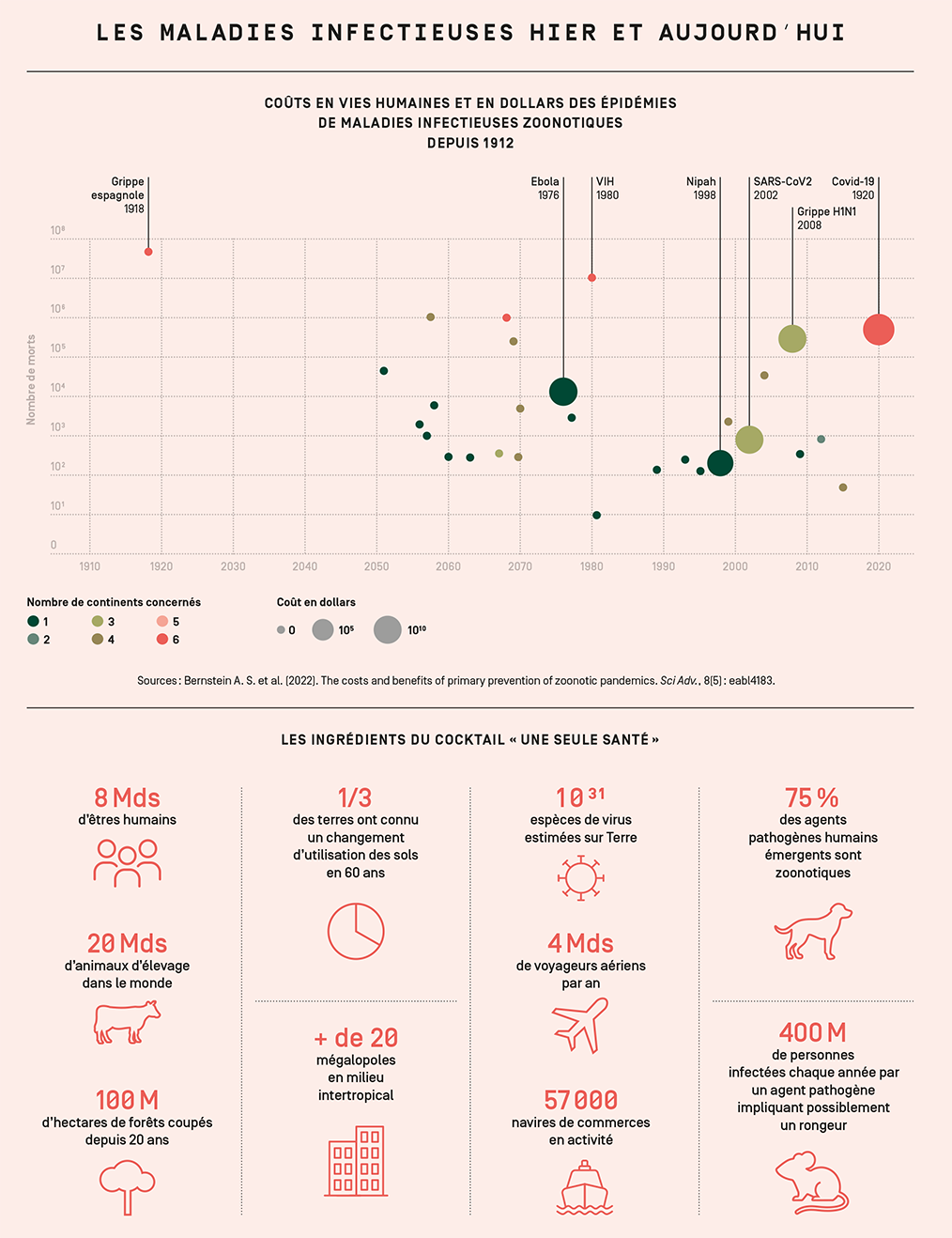
Cette vision globale, dans son approche comme dans les acteurs impliqués, est celle du concept « une seule santé » (One Health en anglais). Né au début des années 2000, il promeut, pour comprendre et prévenir les épidémies, une approche intégrée de la santé humaine, animale et environnementale, trois compartiments intimement liés mais encore trop souvent étudiés et gérés indépendamment. Ce concept tire notamment ses origines d’un constat : ces dernières décennies, les maladies infectieuses émergentes – dues à des agents pathogènes encore inconnus jusqu’ici – voient leur fréquence, leur distribution et les coûts qu’elles engendrent progresser. Parmi elles, les trois quarts sont des zoonoses : avant de toucher la santé humaine, ces maladies ont pour origine des agents pathogènes infectant des animaux (sauvages ou domestiques, voire les deux), eux-mêmes sensibles aux modifications de leur environnement.
Comme naissent les zoonoses ?
« Le mécanisme d’émergence de zoonoses est un phénomène particulièrement rare qui suit une loi de probabilité : il faut un très grand nombre d’essais ratés avant qu’un agent pathogène ne réussisse à passer la barrière d’espèce et touche les populations humaines », rappelle Jean-François Guégan, directeur de recherche IRD, détaché à INRAE, travaillant à l’UMR MIVEGEC, également expert auprès de l’OMS. Autrement dit, plus les contacts entre les populations humaines et animales sont fréquents et diversifiés, plus le risque de voir apparaître une nouvelle maladie infectieuse humaine augmente. La chasse et le commerce d’espèces animales offrent ainsi de nombreuses occasions à un pathogène de passer de l’animal à l’être humain, et inversement. Les grands marchés asiatiques ou africains où se concentrent de nombreux animaux sauvages vivants constituent aussi un terrain favorable pour l’échange d’agents pathogènes entre espèces.
La chasse et le commerce d’espèces animales offrent de nombreuses occasions à un pathogène de passer de l’animal à l’être humain, et inversement.
« En s’enfonçant toujours plus dans les milieux sauvages, qui plus est dans un monde globalisé, où êtres humains et animaux voyagent très rapidement d’un point à l’autre de la planète, on disperse des agents infectieux qui étaient cantonnés dans la forêt depuis des millénaires, reprend Jean-François Guégan. C’est par exemple ce qu’il s’est passé avec le VIH et Ebola. » Ce dernier exemple a été détaillé dans une publication2 parue en 2017 : selon ses auteurs, une émergence d’Ebola a plus de risque de survenir dans des zones déforestées quelques mois auparavant. Non seulement à cause des contacts plus fréquents entre l’être humain et la faune sauvage sur les chantiers de déforestation, mais aussi en raison de la relocalisation de la faune sauvage, cherchant ailleurs un habitat favorable, riche en nourriture comme le sont souvent les zones habitées par les populations humaines. Le virus Nipah en est une illustration bien connue : au tout début des années 2000, l’importante déforestation en Indonésie pour la production d’huile de palme a poussé des chauves-souris à quitter leur habitat naturel pour se réfugier près des populations humaines sur le sous-continent indien. Elles y ont trouvé de la nourriture, notamment des mangues, qu’elles ont contaminées par leur urine. En mangeant ces fruits ou en travaillant dans de grands élevages de porcs qui se nourrissaient de ces fruits, des hommes et des femmes ont été infectés par le virus Nipah, avec un taux de létalité atteignant 70 %. Depuis, un pays comme le Bangladesh connaît presque chaque année une nouvelle flambée épidémique due à ce virus.
Les milieux tropicaux, des terrains fertiles
des inquiétudes sur la possibilité d’émergence de nouvelles zoonoses. Il faut dire qu’ils réunissent à la fois une biodiversité importante, des systèmes d’élevage extensif et de grands élevages industriels, une déforestation marquée, des peuplements humains denses, parfois dans des conditions insalubres… « En milieu tempéré, en Europe par exemple, le contexte environnemental est bien entendu très différent, mais le principe reste le même : ici aussi, l’environnement, la faune sauvage, les élevages et les populations humaines interagissent en permanence », rappelle Nathalie Charbonnel. Cette directrice de recherche INRAE fait partie du Centre de biologie pour la gestion des populations (CBGP), UMR rattachée à plusieurs organismes de recherche français (INRAE, IRD, Cirad, Institut Agro Montpellier). Elle y dirige l’axe dédié aux zoonoses, qui étudie depuis 25 ans les liens entre les agents pathogènes et leurs réservoirs animaux, notamment les petits mammifères. Et ce, en milieu tropical comme dans les pays de l’hémisphère nord.
Des mécanismes de diffusion complexes

« Nos villes, par exemple, concentrent un grand nombre de rongeurs que nous côtoyons quotidiennement. Il y a une forte présence humaine, des animaux domestiques et des lieux favorisant les rencontres, avec des parcs urbains, parfois des zoos », liste Nathalie Charbonnel. BioRodDis, l’un des projets d’envergure qu’elle a récemment coordonné en équipe, s’est ainsi intéressé aux agents pathogènes véhiculés par les rats, souris et autres petits mammifères dans des milieux plus ou moins urbanisés, allant de forêts à des parcs urbains. Avec comme originalité de regarder jusqu’au microbiote intestinal de ces animaux. « Nous souhaitons voir s’il y a un lien entre la composition du microbiote et les agents pathogènes présents. Si c’est le cas, on pourrait évaluer le risque d’infection en analysant simplement le microbiote des animaux via leurs déjections, par exemple. »
Ce projet de trois ans implique bien sûr écologues, virologues et épidémiologistes, mais aussi des gestionnaires de l’environnement et même des sociologues du risque. Les équipes se sont par exemple rendu compte que certaines stratégies de gestion visant à éliminer les rats dans un parc pouvaient avoir un effet délétère en augmentant la présence d’agents pathogènes : en effet d’autres espèces sauvages jouant un rôle dans la régulation de ces agents ont pu être, elles aussi, impactées par ces actions d’éradication des rats.
C’est aujourd’hui tout l’enjeu du concept « une seule santé ». Comprendre les liens entre santé humaine, animale et environnementale constitue déjà un défi pour la recherche, mais ce n’est qu’une première étape nécessaire pour ensuite appliquer cette compréhension aux actions de lutte et de prévention menées sur le terrain.
Un virus au centre des préoccupations mondiales
S’il est bien un virus qui inquiète les spécialistes du monde entier, c’est incontestablement celui de la grippe aviaire – ou plutôt de l’influenza aviaire, le terme « grippe » désignant la maladie lorsqu’elle touche l’être humain.
Même si les contaminations humaines restent aujourd’hui très rares, la rapidité d’expansion du virus au sein des faunes sauvage et domestique et son potentiel de transmission aux mammifères (près d’une quarantaine d’espèces déjà touchées) font de ce virus une potentielle bombe pandémique à surveiller de près.
Les premiers cas aviaires dus au sous-type viral H5N1 sont apparus en Asie en 1996, mais c’est 10 ans plus tard que l’épizootie se propage, atteignant l’Europe à la faveur d’oiseaux migrateurs ou via le transport d’animaux d’élevage. Durant l’hiver 2016-2017, le nombre de cas s’envole, entraînant des abattages massifs dans les élevages européens. À partir de 2020, tout s’accélère : le virus touche un nombre sans précédent d’oiseaux domestiques et sauvages en Asie, Europe et Afrique, avant d’atteindre l’Amérique du Nord en 2021, puis le Sud du continent l’année suivante. Plus de 80 pays sur les 5 continents sont aujourd’hui touchés, avec 250 millions de volailles abattues ces dernières années.

Plus problématique encore, le virus a réussi à de nombreuses reprises à travers le monde à contaminer des mammifères : phoques, renards, ours et même chats. « C’est doublement inquiétant, car la génétique de ces espèces est plus proche de la nôtre, et cela constitue aussi un plus grand nombre de réservoirs pour le virus », alerte la chercheuse INRAE Claire Guinat de l’UMR Interactions hôtes-agents pathogènes (ENVT/INRAE). Un véritable terrain de jeu évolutif pour un virus, qui fait craindre des mutations ou des recombinaisons avec d’autres virus proches, avec comme risque ultime la capacité à se transmettre d’un être humain à un autre. Un véritable scénario catastrophe pour un virus ayant un taux de létalité supérieur à 50 % chez l’homme.
« Il est difficile de prévenir une émergence ; cependant nous pouvons étudier les dynamiques d’émergences et de transmissions passées, notamment les passages inter-espèces, afin de développer des moyens de lutte efficaces pour prévenir une éventuelle diffusion », reprend Claire Guinat. Cette épidémiologiste a décroché en 2023 une bourse accordée par l’European Research Council (ERC) de 1,5 million d’euros sur 5 ans pour l’ambitieux projet TrackFLU. Son terrain d’étude : les immenses marchés de volailles vivantes du Cambodge. « Différentes souches d’influenza aviaire y circulent au sein de plusieurs espèces, avec un niveau de biosécurité très limité : un écosystème parfait pour l’émergence de nouvelles souches. De plus, c’est ici que le plus de cas humains sont apparus. »
Durant la première phase de terrain du projet, les équipes tâcheront de retracer dans le temps et l’espace le trajet et l’évolution des différentes souches virales dans les nombreux marchés du pays, les fermes d’élevage et même la faune sauvage environnante. Dans un second temps, les chercheurs souhaitent développer un outil numérique capable de prédire la transmission du virus à travers tout le réseau et ainsi aider les décideurs locaux à prendre les mesures de contrôle les plus pertinentes, à la source même des épidémies.
Signe de la menace que représente la grippe aviaire, de nombreux projets de ce genre voient le jour à travers le monde. En 2023, l’OMS émettait une liste de recommandations pour atténuer les risques d’émergence : renforcer la surveillance et les enquêtes épidémiologiques comme le fait TrackFLU, se préparer à tous les niveaux à un risque de pandémie (avec par exemple la mise au point de vaccins), mais aussi favoriser la collaboration entre la recherche en santé humaine et celle en santé animale.
1. Franck E. G., Sudarshan A. (2023). « The Social Costs of Keystone Species Collapse : Evidence From The Decline of Vultures in India ». BFI working paper.
2. Olivero J. et al. (2017). « Recent loss of closed forests is associated with Ebola virus disease outbreaks ». Scientific Reports, 7, 14291.
L’environnement, le grand oublié
Souvent négligé dans les travaux se revendiquant de l’approche « une seule santé », l’environnement renferme pourtant des agents pathogènes transmissibles à l’être humain. Les bactéries causant la tuberculose, le tétanos ou la lèpre sont ainsi originaires du sol. « Un tiers des agents infectieux humains sont présents dans le sol, l’eau ou les rhizomes », indique Jean-François Guégan, qui travaille sur la mycobactérie responsable de l’ulcère de Buruli. On a longtemps supposé que cette bactérie causant de graves lésions dermatologiques était transmise par des insectes. « On pense en réalité qu’elle vit dans le système racinaire de certaines plantes et se retrouve dans l’eau lorsque le sol est lessivé, comme après une déforestation », explique-t-il. C’est le cas de bien d’autres agents pathogènes d’origine végétale.
Changement climatique et zoonoses
Comment le changement climatique impacte-t-il les agents pathogènes ? De nombreux vecteurs sont particulièrement sensibles aux conditions climatiques, comme les tiques, dont la période d’activité s’allonge par endroits du fait de températures plus clémentes. Les moustiques eux colonisent de nouveaux territoires devenus plus accueillants. Selon une récente étude 1, la limite sud de l’aire de répartition des moustiques vecteurs du paludisme en Afrique subsaharienne progresserait de 5 km par an. Mais d’autres facteurs entrent en jeu. Ainsi, les transports ont favorisé
la progression du moustique tigre, qui véhicule du chikungunya, de la dengue et du zika en France depuis 2010. Et si certaines régions deviennent plus propices à certains vecteurs, d’autres zones deviennent moins favorables. Ainsi, l’aire de répartition du paludisme en Afrique subsaharienne pourrait régresser dans le Sahel. Le changement climatique a donc bel et bien une influence sur l’évolution des maladies infectieuses, mais avec des effets variés.
1. Carlson C. J. et al. (2023). « Rapid range shifts in African Anopheles mosquitoes over the last century ». Biol. Lett., 19 (2), 20220365
-
Yann Chavance
(Envoyer un courriel)
Rédacteur
