Alimentation, santé globale Temps de lecture 5 min
Mieux comprendre la relation entre l’eau et la cellulose grâce à la résonance magnétique nucléaire
Publié le 06 juillet 2023

La résonance magnétique nucléaire (RMN) est une technique d’analyse de la structure et de la mobilité des atomes et des molécules. Ces mesures de mobilité, appelée dynamique moléculaire, permettent de caractériser des mouvements à des échelles très petites, de l’ordre du nanomètre sur une échelle de temps de la microseconde jusqu’à la picoseconde. Une équipe de recherche de l’unité BIA a utilisé la RMN pour caractériser la structure et la dynamique moléculaire de la cellulose en présence de plus ou moins d’eau.
Pour accéder à la structure chimique d’un solide comme la cellulose par RMN, l’expérience est fondée sur l’acquisition du signal de résonance magnétique (la magnétisation) des noyaux des atomes de carbone constituant les unités glucose de la cellulose. La faible sensibilité des carbones en RMN implique l’usage d’une expérience basée sur le transfert vers les carbones de la magnétisation provenant des noyaux plus sensibles et abondants des hydrogènes (les protons) présents dans la cellulose ou l’eau environnante. Ce transfert permet d’augmenter de manière significative l’intensité du signal des carbones qui portent l’information structurale de la cellulose (configuration et enchaînement des unités glucose, conformation des chaînes…) et de sa dynamique moléculaire en présence d’eau. En augmentant la durée du transfert à chaque expérience RMN, l’intensité des carbones évoluent selon une cinétique appelée courbe de transfert (figure 1) dont l’allure dépend des mobilités moléculaires des chaines de cellulose et de l’eau. Connue depuis les années 70, cette technique appelée polarisation croisée, a été revisitée par l’unité BIA. Ses travaux ont permis de diminuer la durée d’analyse (de 30 à 17 h) tout en augmentant 8 fois le nombre de points établissant cette courbe de transfert (figure 1).

La courbe de transfert est décrite par plusieurs paramètres temporels qui dépendent de la mobilité des carbones et/ou des protons constituant la cellulose et l’eau. Pour estimer ces paramètres, une étape de modélisation de la courbe de transfert est nécessaire. Parmi les paramètres accessibles, le temps de diffusion de spin (noté THH) correspondant au transfert de magnétisation entre protons à travers de petites distances nanométriques et spécifique des fortes interactions moléculaires, a été mis en avant. Ce paramètre a pu être décrit par 3 valeurs différentes appelées THHa, THHb et THHc, qui ont été plus particulièrement étudiées pour comprendre les interactions entre les chaînes de glucose en présence de plus ou moins d’eau.
Appliqué à des celluloses d’origines différentes, il a été montré que le paramètre THHb augmente avec les interactions entre les chaînes de glucose formant les cristaux au sein des fibrilles de cellulose (figure 2, cellulose cristalline et para-cristalline).
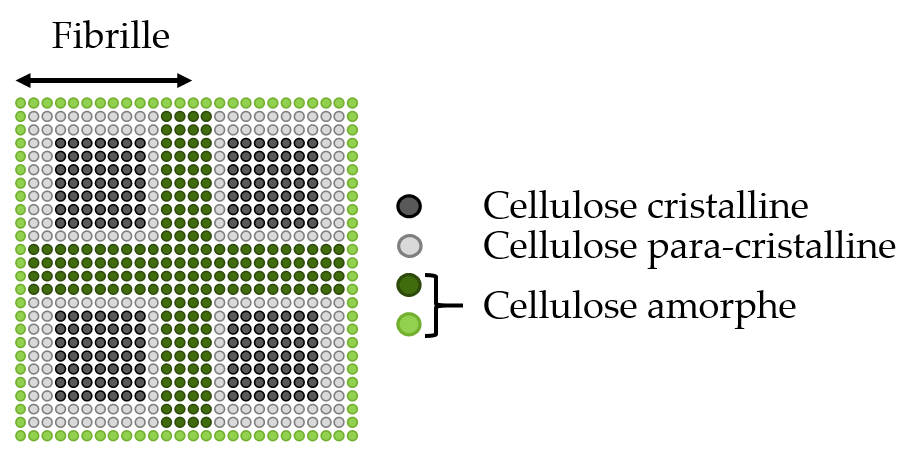
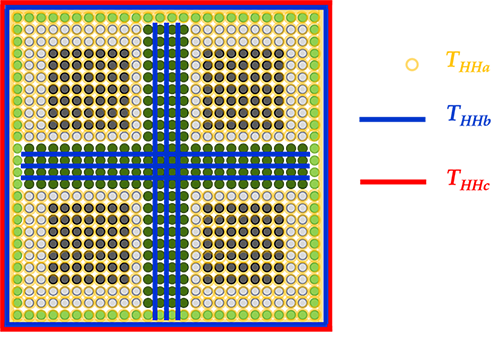
L’ajout de différentes quantités d’eau à la cellulose a montré que le temps de diffusion THHc est principalement affecté par l’hydratation. Ces résultats permettent de formuler des hypothèses sur les interactions eau-cellulose associées aux 3 différents temps de diffusion de spin identifiés (figure 3) :
- THHa : temps de diffusion entre protons, indépendamment de leur origine (cellulose-cellulose ou cellulose-eau) ;
- THHb : temps de diffusion des protons de l’eau de « structure », c’est-à-dire présente « naturellement » en interaction avec les fibrilles de cellulose (~5 %) ;
- THHc : temps de diffusion des protons de l’eau pour une quantité au-delà des 5 %.
Ces résultats et l’approche développée se sont avérés très prometteurs pour la compréhension du rôle de l’eau sur la structuration de la cellulose. Cette approche sera appliquée à d’autres polysaccharides comme l’amidon, puis dans des mélanges de plus en plus complexes, jusqu’à des parois cellulaires végétales. La possibilité de distinguer la contribution de chaque acteur des mélanges sera au cœur des préoccupations. Ainsi, il sera possible de mieux comprendre le rôle de l’eau dans l’établissement des propriétés mécaniques de biomatériaux tels que des films ou assemblages composites, dans la structure des parois cellulaires régulant la texture des fruits et légumes et dans la structure complexe de l’amidon au sein de diverses formulations alimentaires.
PARTENAIRES SCIENTIFIQUES :
Marc Lahaye, unité INRAE BIA (UR 1268)
Corinne Rondeau-Mouro, unité INRAE OPAALE (UR 1466)
PUBLICATIONS ASSOCIÉES :
Falourd X., Lahaye M., Rondeau-Mouro C. (2022). Assessment of cellulose interactions with water by ssNMR: 1H-> 13C transfer kinetics revisited. Carbohydrate Polymers, 298, 120104. https://doi.org/10.1016/j.carbpol.2022.120104
Falourd X., Lahaye M., Rondeau-Mouro C. (2022). Optimization of acquisition and processing times for the measurement of 1H to 13C polarization transfer kinetics. MethodsX, 9, 101914. https://doi.org/10.1016/j.mex.2022.101914
