Bioéconomie Temps de lecture 5 min
L’action des enzymes oxydatives dans les tissus végétaux étudiée par imagerie
Publié le 12 septembre 2024

La transformation de la biomasse végétale en produits d’intérêt nécessite l’action synergique de nombreuses enzymes. Celles-ci agissent sur les polymères comme les polysaccharides (cellulose, hémicelluloses) et les polyphénols (lignine) qui s’assemblent pour former les parois cellulaires des végétaux. L’action enzymatique peut être de deux natures complémentaires : hydrolytique (rupture de liaisons dans ou entre des polymères) ou oxydative (libération de composés oxydés). Bien que ces mécanismes soient relativement bien compris au niveau des polymères individuels, ils demeurent complexe à appréhender à l’échelle tissulaire, surtout pour les enzymes oxydatives appelées les lytic polysaccharide monooxygenases (LPMO). En effet, les enzymes oxydatives, dont le rôle est pourtant essentiel dans les processus de dégradation enzymatique, libèrent des petites molécules, appelées oligosaccharides oxydés, difficiles à détecter et à quantifier.
L’imagerie par spectrométrie de masse, une innovation pour étudier les LPMO en action
Pour étudier l’action des LPMO, les chercheurs INRAE ont adapté une approche d’imagerie par spectrométrie de masse basée sur la désorption-ionisation laser assistée par matrice (MALDI-MS) capable de détecter les oligosaccharides oxydés libérés en faibles quantités par les LPMO au cours de l’oxydation de la cellulose, avec une résolution spatiale de 20 µm. Cette approche permet ainsi de cartographier les modifications chimiques des polysaccharides au sein des parois cellulaires avec une résolution de quelques microns, sans aucun marquage ni sonde spécifique. Cette étude a été menée sur des coupes fines de tiges de maïs, une céréale importante en France pour la nutrition animale, dont les tiges sont des co-produits à fort potentiel de valorisation.
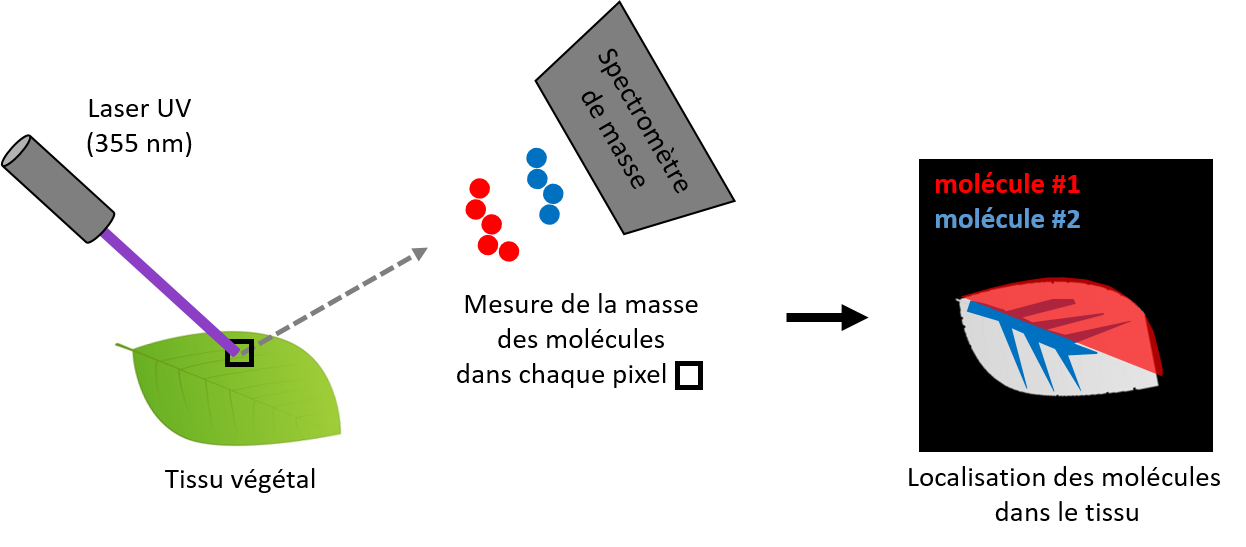
Cartographie des modifications chimiques et synergie enzymatique
L’imagerie par spectrométrie de masse a révélé l’action ciblée des LPMO au sein des parois cellulaires des tiges de maïs. Les résultats obtenus ont permis de démontrer une variabilité chimique et spatiale des oligosaccharides oxydés et non oxydés produits par l’action des LPMO sur les parois puisque les produits oxydés ont été principalement détectés dans les régions peu lignifiées des parois cellulaires. Cette observation suggère que la composition et l’organisation structurale des polymères influencent l’efficacité des LPMO.
Après avoir surmonté les défis techniques initiaux et optimisé les paramètres, les scientifiques ont également pu étudier par cette méthode d’imagerie les interactions synergiques entre une LPMO oxydant la cellulose et un cocktail de cellulases commerciales connues pour hydrolyser la cellulose en glucose.
Perspectives : vers des applications biotechnologiques et un transfert de méthodologie
Ces résultats ouvrent de nouvelles perspectives pour l’utilisation des enzymes dans des cocktails enzymatiques, et plus particulièrement les LPMO, dans des applications biotechnologiques centrées sur la déconstruction des parois cellulaires végétales. En effet, la méthode d’imagerie MALDI-MS développée pour suivre en temps réel l’action des enzymes, est facilement transférable à d’autres couples enzymes/parois végétales afin de mieux comprendre les mécanismes enzymatiques. Ces avancées sont prometteuses tant pour la valorisation de la biomasse végétale en bioproduits que pour la protection des plantes contre les ravageurs afin de mettre en place des protections adaptées.
Référence :
Leroy A, Fanuel M, Alvarado C, Rogniaux H, Grisel S, Haon M, Berrin J-G, Paës G*, Guillon F. In situ imaging of LPMO action on plant tissues. Carbohydrate Polymers 2024, 343, 122465. https://doi.org/10.1016/j.carbpol.2024.122465
