Alimentation, santé globale Temps de lecture 4 min
Guerre dans le microbiote intestinal : des bactéries Listeria produisent un antibiotique de contact
Publié le 05 novembre 2021
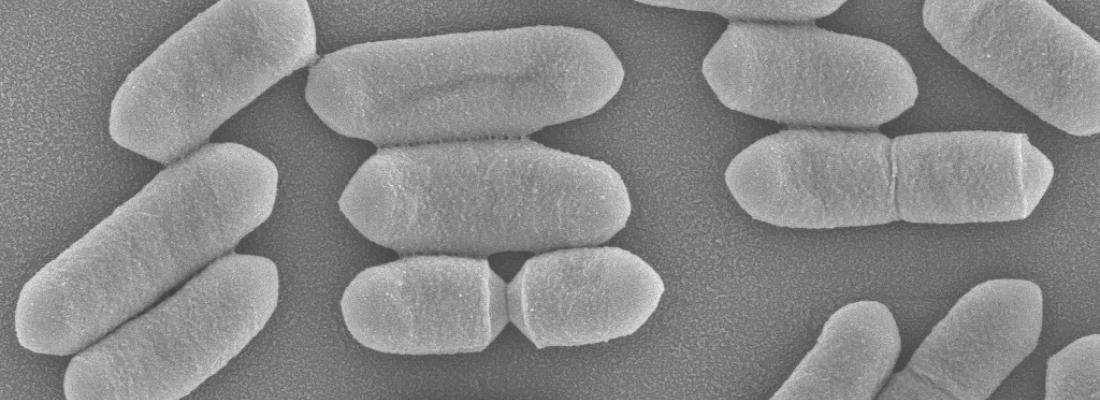
Listeria monocytogenes est une bactérie pathogène qui cause la listériose, une maladie d'origine alimentaire qui peut avoir des conséquences graves chez les personnes immunodéprimées ou âgées, ou les femmes enceintes, en provoquant par exemple des méningites ou des fausses couches. En France, la maladie reste rare (5 à 6 cas par million d’habitants), mais mortelle dans 30 à 40% des cas survenant en dehors de la grossesse.
Les épidémies les plus graves de listériose humaine sont associées à certaines souches particulièrement virulentes de la bactérie Listeria monocytogenes. Ces souches sont capables de produire un peptide, la listeriolysine S, qui a des propriétés antibiotiques.
À la différence d'autres molécules bactériennes ayant des propriétés antibiotiques, la listeriolysine S ne diffuse pas dans l'environnement mais reste associée à la membrane de la bactérie qui l’utilise uniquement pour tuer d’autres bactéries lorsqu’elle entre en contact avec elles.
C’est ce qu’a révélé une étude publiée dans la revue PNAS. et réalisée par plusieurs équipes de l’Institut Pasteur, du CNRS, de l'Inserm, de partenaires espagnols et américains, et de l’unité de recherche INRAE MICALIS au sein de l'équipe Epigénétique et Microbiologie Cellulaire, dirigée Hélène Bierne.
Une action ciblée pour moduler la composition du microbiote
Dans l'intestin des mammifères, la Listeria est donc capable d’exprimer à sa surface la listeriolysine S. La molécule fragilise la membrane de certaines espèces bactériennes avec lesquelles elle entre en contact, ce qui conduit à leur mort. « Certains de nos résultats préliminaires suggèrent que la listeriolysine S est une molécule très hydrophobe, qui n’est pas soluble dans l’eau. Le contact entre une Listeria et une bactérie sensible permettrait donc le passage de la listeriolysine S directement de la membrane de la Listeria à celle de la bactérie sensible, en évitant un passage par le milieu liquide externe », détaille Javier Pizarro-Cerdá, de l'institut Pasteur.
La Listeria est ainsi capable de moduler la composition du microbiote intestinal, afin de moins subir la compétition des autres bactéries. Elle parvient ainsi à mieux infecter l’intestin, puis des organes profonds comme le foie ou la rate, enfin le cerveau ou le placenta. La listeriolysine S est donc associée à la forte virulence des souches qui la produisent.
Une stratégie rare dans le monde bactérien
La découverte de l'activité dépendante de contact de la listeriolysine S est originale car il s'agit d'une stratégie rare dans le monde bactérien. En ne relâchant pas cette molécule dans l’environnement, la Listeria évite que d’autres bactéries, résistantes à cette molécule, puissent bénéficier potentiellement de la présence de la listeriolysine S. "De plus, complète Javier Pizarro-Cerdá, la Listeria va tuer uniquement les bactéries qui profitent du même environnement et des mêmes ressources qu’elle. Elle tue uniquement les bactéries qui se trouvent proches d'elle, et ne gaspille pas ses ressources en produisant une molécule qui pourrait aller loin tuer d'autres bactéries."
"Ce qui est également intéressant, indique Hélène Bierne, c'est que la Listeria a développé une "immunité" contre la listeriolysine S, évitant aux bacilles de cette espèce de s'autodétruire quand ils forment des contacts entre eux."
Cette avancée inédite a été possible grâce aux nombreuses connaissances accumulées depuis des années sur cette bactérie et à l’utilisation de techniques avancées de microscopie. L'équipe INRAE, Epigénétique et Microbiologie Cellulaire dirigée Hélène Bierne, a contribué à cette découverte par son expertise sur les propriétés moléculaires de la surface de ce pathogène alimentaire.
