Alimentation, santé globale Temps de lecture 6 min
La modélisation en pratique dans la gestion d’une épidémie
Publié le 12 mai 2020
A partir de quoi sont réalisées ces prévisions ?
Ces prévisions quantifiées sont des simulations obtenues par des modèles mathématiques qui sont élaborés en plusieurs étapes (Cf. figure 1).
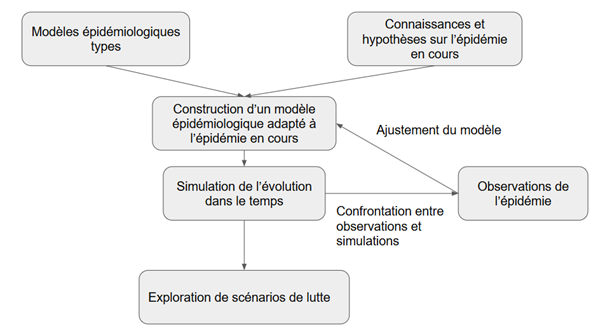
Figure 1. Schéma d’élaboration d’un modèle épidémiologique
Des connaissances et des hypothèses sur l’épidémie servent à élaborer des modèles épidémiologiques. Les prévisions sont ainsi des simulations construites à partir d’hypothèses et des connaissances sur l’épidémie traduites en modèles mathématiques. Les modèles sont ajustés pour que leurs prédictions soient cohérentes avec les données de terrain (nombre de décès, nombre de malades… par exemple). Leur validité est donc étroitement liée à la pertinence des hypothèses sur lesquellesils sont bâtis et à la fiabilité et à la richesse des données disponibles. Les hypothèses sont posées en particulier:
- sur les groupes de populations à considérer. Par exemple, on prend en compte plusieurs classes d’âge car on fait l’hypothèse que la transmission dépend de l’âge.
- sur les choix adoptés pour traduire les connaissances en équation. Par exemple, en l’absence de nouvelles contaminations, on fait l’hypothèse que le nombre de personnes malades décroît exponentiellement.
L’utilisation des données de terrain permet au fil de l’épidémie de ré-évaluer régulièrement la pertinence des modèles et de leurs hypothèses, de les ajuster si nécessaire, et de prévoir de manière quantitative quel serait l’impact de différentes mesures.
Les calculs permettant d’obtenir ces simulations comportent toujours un degré d’incertitude dont il faut tenir compte : chaque résultat associé à un scénario donné est situé dans une fourchette qui s’étend globalement de la prévision la plus pessimiste à la plus optimiste.
Un modèle épidémiologique pour les maladies transmissibles, comment ça marche ?
Le modèle de base épidémiologique considère le nombre de personnes infectées mais aussi le nombre de personnes pas encore atteintes (sensibles) et le nombre de personnes guéries (résistantes) : leur nombre progresse selon la contagiosité de la maladie et selon la part de la population encore sensible, ainsi que celle devenue résistante. On parle de modèle SIR (sensibles, infectés, résistants ou guéris) (Cf. Figure 2).
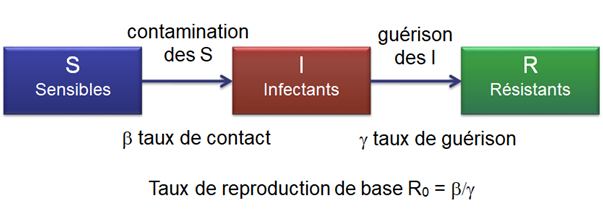
Figure 2. Représentation schématique d’un modèle de base SIR avec ses trois compartiments et la définition du taux de reproduction de base R0 associé.
Le taux de reproduction de base R0 représente la contagiosité de l’épidémie : combien de personnes sont infectées à partir d’une personne infectée unique ; il est directement lié au taux de contact et au taux de guérison.
Ce modèle est adapté pour les maladies transmissibles touchant des populations animales aussi bien qu’humaines.

A quoi sert la modélisation ?
Représenter la réalité pour comprendre
Dans un premier temps, un modèle sert à représenter la réalité sous un format simplifié pour comprendre les principaux mécanismes en jeu.
Dans le cas de COVID-19, différentes sources de données concernant la surveillance de l’épidémie à différentes échelles peuvent être utilisées, par exemple :
- les données mondiales disponibles sur le site de Johns Hopkins University (nombre de cas détectés par PCR, nombre de morts)
- des données nationales plus détaillées comme les données hospitalières françaises .
Les modèles peuvent être complexifiés pour mieux représenter la réalité en introduisant par exemple plusieurs catégories de personnes sensibles suivant l’âge, différents symptômes, des populations ayant des comportements différents, ou une dimension spatiale. C’est ce qui a été le cas de la modélisation du COVID-19 avec deux approches :
- par des modèles mathématiques de plus en plus complexes :
- en ajoutant des compartiments pour représenter différentes catégories de personnes (e.g.. le modèle de l’équipe de S. Alizon de l’UMR MIVEGEC qui comporte 10 compartiments);
- en prenant en compte l’aléa c’est à dire l’incertitude autour de la survenue d’événements (e.g., modèle de l’équipe de N. Ferguson de l’Imperial College, de l’équipe de V. Colizza de l’iPLESP) ;
- en ajoutant l’espace : la prise en compte des distances, des réseaux d’échange, de l’hétérogéneité dans les territoires.
- par l’ajout d’une approche statistique selon laquelle la probabilité de chaque événement (par exemple être contaminé) est estimée à partir de facteurs comme l’âge et le sexe (e.g., modèle de l’équipe de S Cauchemez). Par ces estimations, on peut affiner la quantification de certains paramètres comme le taux de mortalité selon l’âge et le sexe.
A titre d’illustration, nous représentons un modèle à 11 compartiments développé et calibré au sein de l’UMR EPIA à partir des données françaises (hospitalières et d’autres sources) ainsi que des simulations correspondantes (Cf. Figure 3).
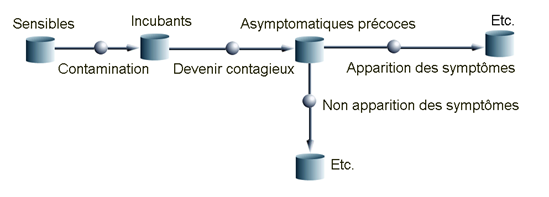
Figure 3a. Extrait du modèle et évolutions temporelles observée et simulée du nombre quotidien de patients en hospitalisation et en service de réanimation en France.
Un extrait du modèle représentant les compartiments initiaux.
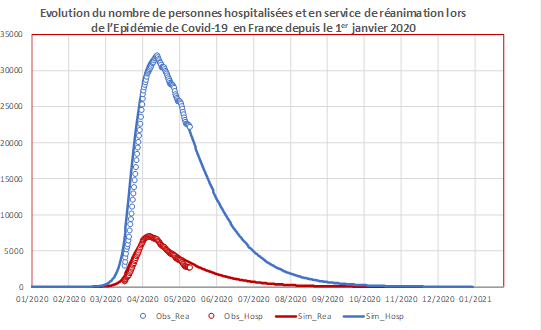
Figure 3b. Extrait du modèle et évolutions temporelles observée et simulée du nombre quotidien de patients en hospitalisation et en service de réanimation en France.
Les points circulaires correspondent aux données hospitalières observées en France jusqu’au 11 mai 2020 (hospitalisations en bleu, services de réanimation en rouge).
Les courbes correspondent aux données simulées par un modèle développé par l’UMR EPIA (hospitalisation en bleu, service de réanimation en rouge) à partir d’un modèle compartimental simple sans dimension spatiale avec prise en compte du confinement à partir du 17 mars 2020 et calibré sur les données disponibles sur le site de Johns Hopkins University et sur le site de data.gouv.fr sur les données hospitalières français. Il n’est pas envisagé dans cet exemple de lever de confinement.
La collaboration de tous est nécessaire
Dans le cas d’une maladie émergente sur laquelle la connaissance est en train de se construire, ces prévisions doivent s’affiner à mesure que les connaissances se renforcent. La collaboration des scientifiques mais aussi de toutes les parties prenantes de l’épidémie est ici essentielle pour mettre à disposition les données et les connaissances : médecins, systèmes de surveillance, gestionnaires de santé, industries de la santé. La gestion d’une épidémie implique pour les décideurs de prendre en compte les aspects sanitaires, y compris la prise en charge des besoins de santé sans lien avec l’épidémie, mais aussi les conséquences socio-économiques générées par la fermeture des écoles, le confinement des travailleurs, la modification des chaînes d’approvisionnement, le recueil de données personnelles.
Explorer des scénarios
Face à une nouvelle épidémie, il faut définir une stratégie de lutte, explorer si on veut viser l’atténuation de l’épidémie ou la suppression. La modélisation permet à moindre coût d’explorer des scénarios intermédiaires basés sur l’utilisation de différents leviers pour limiter la transmission (modalités du lever du confinement, capacité à identifier et isoler les personnes infectantes, traitement réduisant le taux de mortalité ou le taux de passage en réanimation…) en attendant l’arrivée à plus long terme d’un vaccin efficace. Elle est essentielle pour anticiper les conséquences de ces différents scénarios car elle est la base de l'expertise sanitaire en appui aux politiques publiques.
Anticiper le futur et quantifier les effets des choix de politiques de santé publique
Les modèles sont particulièrement utiles actuellement pour explorer les scénarios de déconfinement avec différents leviers possibles pour limiter la transmission. Pendant le confinement en France métropolitaine, le R0 a diminué d’environ 3,4-3,3 avant confinement à une valeur proche de 0.7-0,5, soit une baisse d’environ 85 % (cf. référence). L’objectif est de comprendre les conditions dans lesquelles la maladie est maîtrisée grâce à une transmission du virus limitée (R0 < 1) ou faible (autour de 1) afin de limiter les conséquences sanitaires de la circulation du virus, tout en réduisant les conséquences socio-économiques du confinement.
On peut schématiquement représenter les différentes mesures qui s’offrent à nous pour contrôler la maladie : mesures sanitaires, mesures médicales et vaccination (Cf. figure 4) .
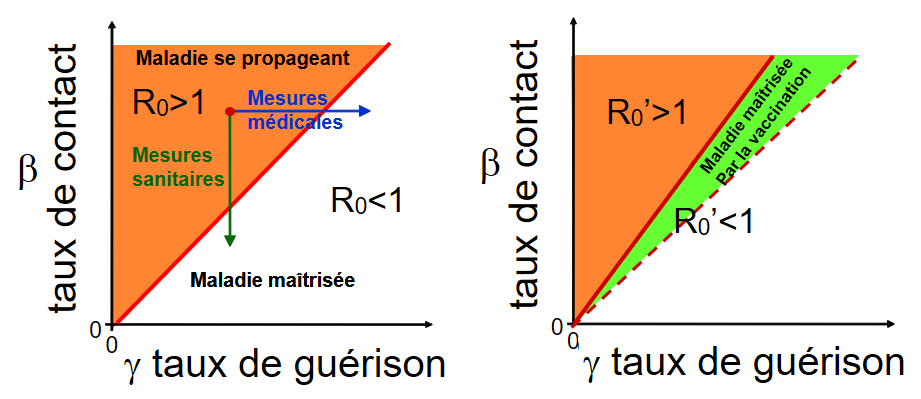
Figure 4 - Représentation du R0= taux de contact / taux de guérison .
Schéma de gauche : La droite correspond au cas où R0 = 1, c’est à dire où le taux de contact est égal au taux de guérison. Les points au-dessus de la bissectrice (zone en rouge) représentent les cas où le R0>1 et la maladie se propage. Les points en dessous représentent les cas où R0<1 et la maladie est contrôlée. Les mesures médicales tendent à augmenter le taux de guérison et les mesures sanitaires tendent à diminuer le taux de contact.
Schéma de droite : Si on vaccine, la maladie ne se propage que dans la partie non vaccinée de la population et dans ce cas le nouveau R0’ est égal à R0 que multiplie la fréquence de population non vaccinée. La zone où la maladie est maîtrisée après vaccination R0’<1 est plus grande car il y a une nouvelle zone où la maladie est maîtrisée par la vaccination (zone en vert).
Il est intéressant d’associer différentes mesures pour atteindre plus rapidement les conditions pour lesquelles R0<1 ou R0’<1.
Par exemple pour le covid-19, des mesures sanitaires permettent de :
- Limiter le nombre de contacts entre personne infectées et personnes sensibles : confinement régionalisé, organisation du travail (télétravail..), maintien ou pas de la fermeture des écoles, ouvertures partielles des commerces, limitation de rassemblements, tests virologiques pour identifier les personnes infectées et isoler ces personnes et les contacts qu’elles auraient eus durant la période pendant laquelle ils sont porteurs du virus, etc.
- Limiter l’efficacité de la transmission du virus au cours des contacts : mesures barrières (port du masque, lavage des mains, etc.).
Des mesures médicales comme un traitement permettraient de limiter la durée infectieuse c’est à dire augmenter le taux de guérison. Par ailleurs, l’augmentation du taux de guérison a un autre effet bénéfique en diminuant la mortalité. La vaccination permettrait de limiter le nombre d’individus sensibles, ce qui diminue de fait le R0.
A titre d’illustration, nous représentons avec le modèle précédent l’évolution du nombre de décès en fonction de plusieurs scénarios correspondant à des niveaux de confinement plus ou moins restrictifs (Cf. Figure 5).
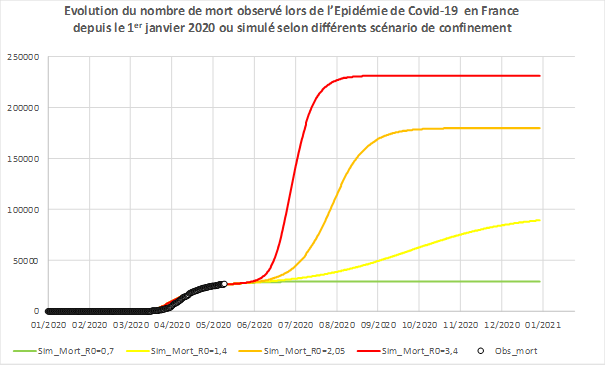
Figure 5 - Evolution temporelle observée et simulée du nombre cumulé de décès quotidien en France. Les points circulaires en noir correspondent aux données de mortalité observées en France jusqu’au 11 mai 2020.
Les courbes correspondent aux données simulées par le même modèle que celui de la figure 3.
- En vert, le confinement s’applique sur toute l’année 2020 (le R0 reste à 0,7).
- Pour les autres courbes, le confinement est levé au 15 mai 2020 mais la transmission est plus ou moins contenue avec diverses actions (port de masques, limitation des regroupements etc).
. En jaune, la contagiosité serait le double de celle observée en confinement actuel (R0 = 1,4).
. En orange, elle serait à mi-chemin entre celle d’avant confinement et celle durant le confinement (R0=2,05).
. En rouge, le confinement est entièrement levé et la transmission reprend avec la même efficacité qu’avant le confinement (pas de geste barrière, etc) (R0 = 3,4).
Ces courbes permettent à chacun de mieux visualiser les raisons qui ont motivé les options de confinement, en visualisant notamment le total des décès épargnés par cette décision (sur le schéma : différence entre la courbe rouge et la courbe verte).
En l’absence de solutions médicales pour diminuer les décès dûes à la maladie et sous les hypothèses envisagées (par exemple, absence de saisonnalité de l’infection), les scénarios jaune orange et rouge avec une contagiosité qui repasserait au-dessus de 1 suite au déconfinement (R0>1) montrent que l’épidémie reprendrait et que les décès recommenceraient à augmenter au bout d‘un certain temps. Cela justifie la mise en place de mesures accompagnant le déconfinement et visant à limiter la contagiosité (tester, tracer, isoler) et pourrait justifier de nouvelles mesures pour contenir l’épidémie, c’est-à-dire infléchir encore la courbe vers le bas pour minimiser le nombre de nouveaux décès liés au COVID-19.
Faire bon usage des prévisions…
Quels que soient leurs niveaux de complexité, les modèles ne sont que des approximations de la réalité, basés sur des hypothèses qui peuvent elles-mêmes évoluer. Par ailleurs, la connaissance de la situation par le grand public modifie les comportements et ainsi la transmission, même en l’absence d’action de santé publique. Aussi, dans le cas d’une nouvelle maladie à répartition mondiale, il est difficile de prédire l’évolution de l’épidémie sur plusieurs mois. Les modèles restent indispensables pour envisager l’avenir et devront être adaptés à l’évolution du contexte et des connaissances comme cela a déjà été le cas en ce début d’année 2020.
Concernant l’épidémie de covid-19, des inconnues cruciales sur la dynamique du virus demeurent. Par exemple, nous savons encore peu de choses sur la force protectrice de la réponse immunitaire contre de futures ré-infections. Nous ne savons pas non plus si la circulation du virus peut être atténuée par les saisons chaudes. Enfin, nous nous ne savons pas si des foyers viraux perdureront au niveau mondial comme c’est le cas de la grippe. Aussi, il est difficile de savoir pendant combien de temps il faudra agir pour limiter la transmission du virus.
Ainsi, les éléments qui permettraient un relâchement total des mesures limitant la transmission seraient qu’:
- un traitement efficace ait été trouvé, limitant les conséquences et la propagation de l’épidémie ;
- un vaccin efficace ait été mis au point, au mieux d’ici 18 mois à 2 ans, permettant de mettre fin à la circulation du virus sans nouvelles infections ;
- la population ait acquis suffisamment d’immunité collective (60%-70%) pour limiter la transmission dans un fonctionnement normal de notre société. Mais cela représente des morts supplémentaires le temps que l’immunité s’installe.
Si on arrivait à supprimer la circulation du virus en France ou en Europe du fait de mesures sanitaires, donc sans acquisition d’une immunité de groupe, il faudrait veiller à limiter l’introduction de nouveaux cas par
- les mesures efficaces de surveillance sur les réintroductions de la maladie
- ou une réduction drastique de la circulation au niveau mondial.
Etant donné le peu de visibilité que nous avons sur ces différents éléments, il est important d’agir pour limiter la transmission du virus dans les mois qui viennent, après le déconfinement partiel, et d’acquérir des informations pour mieux préciser l’avenir.
PCR : Polymerase Chain Reaction
Références :
a/ Henrik Salje, Cécile Tran Kiem, Noémie Lefrancq, Noémie Courtejoie, Paolo Bosetti, et al.. Estimating the burden of SARS-CoV-2 in France. 2020. pasteur-02548181
2020. Effect of a one-month lockdown on the epidemic dynamics of COVID-19 in France. https://hal.archives-ouvertes.fr/hal-02550441 INRAE BioSP - Unité de Biostatistiques et Processus Spatiaux
