Alimentation, santé globale Temps de lecture 4 min
Voir les enzymes du microbiome pour mieux comprendre leurs fonctions
Publié le 03 mai 2022
La redécouverte du microbiote intestinal, autrefois appelé flore intestinale, a bouleversé une partie de la connaissance que nous avons de la santé humaine. Il jouerait en effet un rôle majeur dans de nombreuses maladies métaboliques (diabète, obésité), des pathologies digestives et également dans la prédisposition à certains cancers. Ces bactéries qui nous colonisent peuvent donc être des alliées précieuses pour notre santé.
Depuis plus de 10 ans, des efforts considérables ont été réalisés par la communauté scientifique, notamment à l’INRAE, pour explorer cette « matière noire ». Si l’on connaît bien maintenant les organismes et les espèces qui le constituent, on comprend encore mal ses fonctions au niveau moléculaire. C’est notamment le cas des enzymes produites par le microbiote, dont il a été prédit qu’elles seraient bien plus diverses que celles issues de notre propre génome.
Pour comprendre le rôle de ces enzymes, il est nécessaire de combiner des approches de pointe en biochimie, spectroscopie et biologie structurale. Ces dernières requièrent notamment l’utilisation de grands instruments, tels que le puissant rayonnement du synchrotron SOLEIL. En effet, en plus de déterminer l’activité de ces enzymes, il est essentiel de visualiser et de déterminer leur structure 3D à l’échelle atomique. Ceci permet non seulement de caractériser ces enzymes en détail, mais également de comprendre les secrets des transformations biochimiques qu’elles effectuent et donc leurs rôles dans la cellule et au sein du microbiome. Difficulté supplémentaire, nombre de ces enzymes sont sensibles à l’oxygène et à la lumière, car elles renferment en leurs cœurs des cofacteurs (des assemblages de métaux et de molécules organiques) souvent instables hors de la cellule.
Découverte d’une famille d’enzymes émergentes
Parmi les différentes familles d’enzymes du vivant, l’une d’elles, particulièrement importante, a émergée récemment et a été appelée « enzymes à radical SAM ». S’il est connu depuis longtemps que ces métallo-enzymes jouent un rôle clé pour la physiologie bactérienne, notamment via la biosynthèse de vitamines et de cofacteurs, récemment, nous avons démontré le rôle de ces enzymes au sein du microbiote. En effet, ces enzymes sont notamment impliquées dans la colonisation bactérienne du tractus digestif et la biosynthèse de nouveaux antibiotiques. Néanmoins, de nombreuses fonctions restent encore à découvrir.
Ainsi, récemment, il s’est avéré qu’une de ces enzymes à radical SAM (la Mmp10) joue un rôle clé dans la production de méthane, par la modification d’une autre enzyme (la MCR ou methyl-coenzyme M reductase) qui catalyse l’étape ultime de formation du méthane. Cette modification post-traductionnelle, qui touche un des acides aminés qui constituent la MCR, implique la formation d’une liaison carbone-carbone sur un atome inerte. Or, pour réagir, les atomes de carbone ont généralement besoin d’être activés. À l’exception des enzymes à radical SAM, aucune autre famille d’enzymes n’est capable de former une liaison carbone-carbone sur des atomes non-activés.
Comment ces enzymes peuvent-elles faire une telle réaction ? Pour répondre à cette question, nous avons combiné différentes approches (biochimie, spectroscopie et biologie structurale) afin d’analyser et décrypter le mécanisme de la Mmp10. En particulier, cette enzyme a été cristallisée en absence d’oxygène et à l’abri de la lumière. Les cristaux obtenus, analysés au synchrotron SOLEIL, ont révélé que la Mmp10 possède une architecture unique avec deux co-facteurs organiques (la S-adénosyl-L-méthionine ou SAM et la cobalamine) et quatre co-facteurs métalliques constitués de Fer, de Sodium et de Cobalt, une première surprise (Figure 1). En effet, jamais une telle combinaison et une telle diversité de métaux n’avaient été observées chez une enzyme.
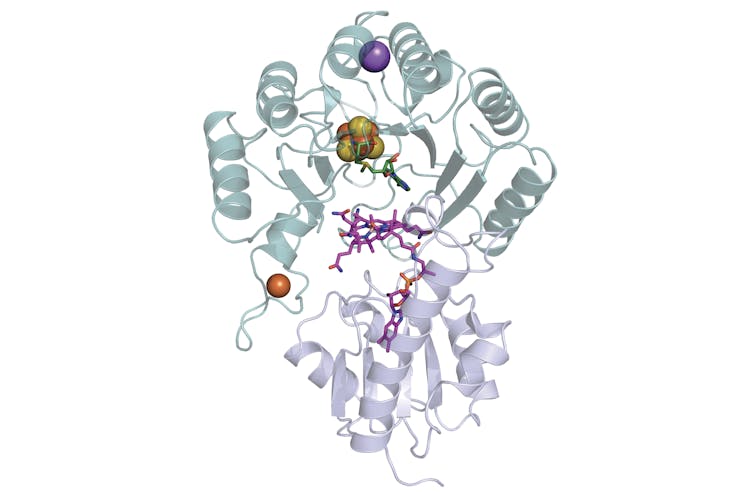
Figure 1 : Structure 3D de la Mmp10 en interaction avec ses cofacteurs : la S-adenosyl-L-methionine (SAM, en vert), son centre fer-soufre ([4Fe4S], sphères oranges et jaunes), la cobalamine (magenta), son site à fer (Fe, en orange), son site cationique avec un ion sodium (Na, en violet)sont représentés. Le domaine radical SAM (en vert) ainsi que le domaine cobalamine (en mauve), sont indiqués.
Des transformations biochimiques complexes
L’autre surprise a été de découvrir qu’au cours de la catalyse, ces co-facteurs se réorganisent. Cela entraîne un réarrangement majeur du site actif de l’enzyme, c’est-à-dire l’endroit au sein de l’enzyme où se déroule la réaction. Dans quel but ?
Pour modifier la MCR, la Mmp10 doit utiliser une chimie particulièrement puissante appelée « chimie radicalaire », à l’origine des fameux « radicaux libres ». Dans le cas présent, l’enzyme Mmp10 va capter un électron via son centre [4Fe4S] pour activer son premier co-facteur (la SAM) qui va générer une espèce radicalaire pour activer à son tour la MCR. Ceci va déclencher une réaction en chaîne, aboutissant à l’activation d’un atome de carbone de la MCR et au transfert d’un groupement méthyle de la cobalamine (le deuxième cofacteur de la Mmp10) vers la MCR. Une fois cette modification terminée, une deuxième molécule de SAM vient alors recharger la cobalamine pour le prochain cycle catalytique (Figure 2). En effet, pour ajouter à la complexité de cette réaction, la SAM ne sert pas uniquement à activer la MCR, mais elle est également la source du groupement méthyle présent sur la cobalamine et transféré ultimement à la MCR. Ainsi, la SAM joue un double rôle pendant la réaction.
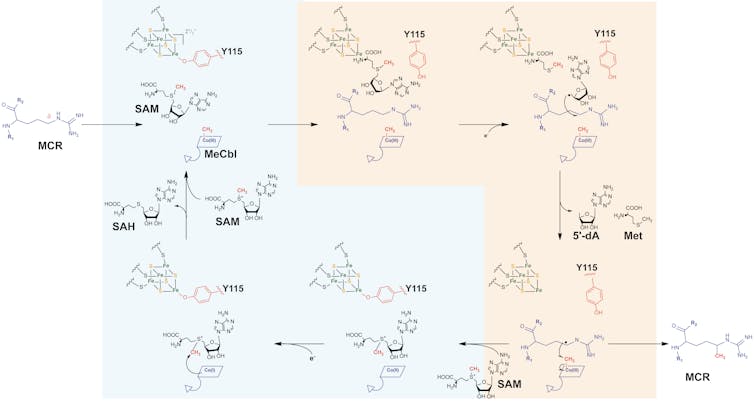
Figure 2 : Mécanisme de la Mmp10. L’enzyme MCR est modifiée par la Mmp10 selon la réaction suivante. Tout d’abord, une molécule de SAM (S-adenosyl L methionine) se fixe au centre [4Fe4S] après interaction entre la Mmp10 et la MCR. Après réduction par un électron (e-), la SAM est clivée en 5’-deoxyadenosine (5’-dA) qui active la MCR. Un groupement méthyle porté par la cobalamine (MeCbl) peut alors être transféré sur la MCR, activant l’enzyme. Une deuxième molécule de SAM vient alors recharger la cobalamine pour le prochain cycle catalytique.
Comment la Mmp10 peut-elle contrôler cette réaction ? Notamment maîtriser la chimie radicalaire pour activer la MCR, et prévenir la formation de réactions parasites qui pourraient endommager la Mmp10, elle-même ? Comment une enzyme peut-elle utiliser la SAM à la fois pour produire une espèce radicalaire et pour transférer un groupement méthyle à la cobalamine ?
Quand la structure 3D éclaire la fonction
L’obtention de la structure de la Mmp10 à très haute résolution a permis de répondre à une partie de ces questions et de comprendre comment l’enzyme accomplit ce tour de force. Notamment, notre étude structurale a révélé l’astuce inventée par la Nature pour que la Mmp10 « sache » si elle doit utiliser la SAM pour générer une espèce radicalaire pour activer la MCR ou transférer un groupement méthyle à la cobalamine.
De façon inattendue, nous avons montré qu’un résidu d’acide aminé de la Mmp10 (une tyrosine) vient protéger, physiquement, le centre métallique radicalaire [4Fe4S] de l’enzyme en absence de la MCR et prévenir ainsi toute interaction avec la SAM. Dans cet état conformationnel, la SAM interagit avec la cobalamine via son atome de cobalt pour lui donner son groupement méthyle, ce même méthyle qui sera par la suite greffé sur la MCR.
Une fois cette réaction effectuée, l’interaction avec la MCR va « débloquer » le centre radicalaire [4Fe4S]. Une nouvelle molécule de SAM va alors pouvoir interagir avec lui, générant un intermédiaire radicalaire extrêmement puissant qui va activer la MCR et permettre au groupement méthyle (installé sur le cobalt) d’être finalement transféré sur cette dernière. Ainsi, la MCR a son site actif modifié, et va pouvoir produire de façon efficace du méthane.
L’obtention de plusieurs structures de la Mmp10 dans différents états conformationnels a également permis de reconstituer le film de la réaction catalysée par Mmp10, étape par étape (Figure 3).
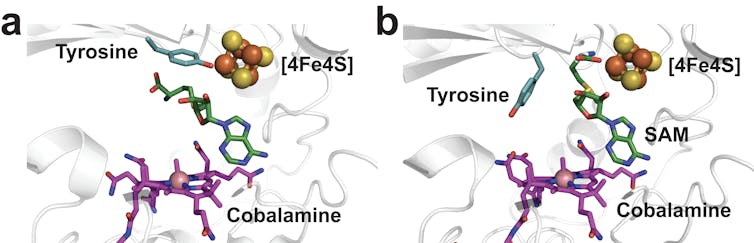
Figure 3 : Réarrangement du site actif de la Mmp10 au cours de la réaction. (a) Le centre fer-soufre ([4Fe4S] : sphères oranges et jaunes) est coordonné par un résidu d’acide aminé de la Mmp10 (tyrosine, en bleu) empêchant l’interaction avec l’un des co-facteurs, la S-adenosyl L-methionine (SAM, en vert). Le second co-facteur de la Mmp10 (cobalamine) est représenté en magenta. En présence de la MCR (b), la tyrosine se dissocie du centre [4Fe4S] et la SAM peut alors s’y coordonner et la réaction se dérouler. Olivier Berteau, Alhosna Benjdia, Fourni par l'auteur
Les conséquences de ces travaux ? Notre étude démontre que les enzymes, notamment celles du microbiote, ont des structures et des mécanismes bien plus divers que ce qui était anticipé. Cette étude représente également une avancée majeure dans notre compréhension de la capacité des enzymes à radical SAM à catalyser un grand nombre de réactions, souvent sans équivalent dans le vivant et essentielles pour la vie des bactéries, mais aussi celle des humains.
Enfin, la découverte de ces nouveaux biocatalyseurs nous permet de mieux comprendre les fonctions du microbiote, notamment son impact sur la santé humaine. De manière surprenante, ces nouvelles enzymes représentent également une source d’inspiration pour développer de nouveaux catalyseurs biomimétiques ou de nouvelles voies de biosynthèses, plus respectueuses de l’environnement pour la synthèse de molécules d’intérêt, des antibiotiques aux précurseurs (synthons) utilisés en synthèse chimique. Encore des surprises à prévoir avec les enzymes à radical SAM !
Olivier Berteau, Chercheur en biochimie et biochimie synthétique, Inrae et Alhosna Benjdia, Chercheuse en biochimie et biochimie synthétique, Inrae
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.