Alimentation, santé globale Temps de lecture 3 min
Première visualisation d’une réaction enzymatique radicalaire, pourquoi, comment ?
Publié le 13 avril 2016

Les chercheurs ont décrit pour la première fois le mécanisme de formation d’une liaison carbone-soufre de façon très détaillée, à l’échelle des échanges d’électrons entre atomes.
Pourquoi s’intéresser à cette réaction ?
Cette liaison carbone-soufre est très difficile à former, car les atomes de carbone engagés dans d’autres liaisons ne sont pas réactifs. Pourtant, les composés soufrés ont un rôle très important dans la chimie cellulaire. On pense en particulier qu’un cofacteur soufré est indispensable à la maturation des hydrogénases, des enzymes dont l’étude sous-tend de forts enjeux. En effet, ces enzymes, présentes chez les microorganismes, produisent de l’hydrogène1, une forme d’énergie chimique « propre » prometteuse pour l’avenir.
La liaison carbone-soufre joue aussi un rôle clé dans la synthèse de nombreuses molécules naturelles dont certains antibiotiques.
Cette liaison, indispensable mais véritable défi pour la chimie classique, peut être réalisée au sein d’enzymes particulières appelées « SAM »2, mises en évidence au début des années 2000.
Les enzymes de l’impossible
Ce que ne peut pas faire la chimie classique, les enzymes de type SAM sont capables de le faire via la chimie radicalaire. Cette chimie est basée sur la formation de radicaux, en l’occurrence des atomes de carbone hautement réactifs car ils possèdent un électron non apparié. Ces composés sont capables de réagir avec de nombreuses molécules et peuvent de ce fait avoir des effets délétères dans les cellules. Les enzymes de type SAM sont capables de maîtriser cette chimie dite « radicalaire » puissante mais explosive. Dans les organismes vivants, ces enzymes peuvent catalyser plus de 70 réactions différentes : synthèse de cofacteurs activateurs d’enzymes (hydrogénases par exemple), mais aussi synthèse de composés cycliques tels que des vitamines ou des antibiotiques.
La réaction radicalaire étape par étape
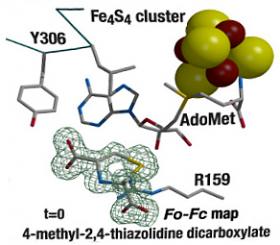
Les chercheurs ont cristallisé une enzyme SAM particulière (SAM HydE), impliqué dans l’activation d’une importante famille d’hydrogénases. Ils ont « designé » le premier substrat fonctionnel à base de soufre de cette enzyme, capable non seulement de se fixer dans le cristal mais aussi de déclencher la formation d’une liaison carbone-soufre dans le cristal et aussi en solution. Ils ont suivi cette réaction étapes par étapes au sein du cristal dans le site actif complexe de l’enzyme.
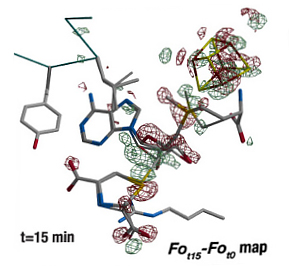
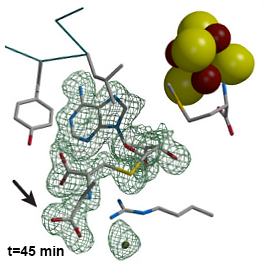
Ces résultats éclairent le fonctionnement d’un type d’enzyme SAM et son rôle dans le mécanisme d’activation des hydrogénases, encore mal connu. Ils répondent à deux grands enjeux : d’une part, des stratégies de synthèse organique plus performantes, d’autre part, l’utilisation, dans le futur, de ces enzymes comme outils biotechnologiques.
1 L’hydrogène peut être converti en électricité, en chaleur ou en force motrice et a ainsi de nombreuses applications possibles : stockage d’énergie dans les bâtiments, réservoir d’hydrogène associé à une pile combustible pour améliorer l’autonomie de véhicules électriques, composant chimique très employé dans l’industrie. L’hydrogène est déjà largement utilisé dans le domaine de l’aérospatial comme combustible pour la propulsion des fusées.
2 SAM : enzymes à radical S-adenosyl-L-méthionine.
Référence
Roman Rohac et al. 2016. Carbon-sulfur bond-forming reaction catalysed by the radical SAM enzyme HydE. Nature Chemistry DOI : 10.1038/nchem.2490
Collaboration Institut de biologie structurale (CEA-CNRS-UGA), Institut Micalis (Inra-Agroparitech-Upsay), Institut nanosciences et cryogénie (CEA-UGA).
Comment visualiser une réaction chimique ?
Bien sûr, on ne peut pas (encore ?) voir physiquement des atomes et des électrons. En effet, les techniques de microscopie les plus puissantes s’arrêtent à l’échelle de grosses molécules, ce qui est déjà un progrès extraordinaire, que l’on croyait théoriquement impossible au 19è siècle1.
Pour étudier la formation de la liaison carbone-soufre, les chercheurs ont déclenché la réaction directement dans un cristal de l’enzyme. Ils ont figé des images obtenues en cristallographie par rayons X à différents stades. Ces données, complétées par une étude par résonance magnétique nucléaire, par des mesures d’activité en solution et par des calculs théoriques, ont permis de de reconstituer le déroulement de la réaction à l’échelle des électrons.
1 Distinguer des protéines en microscopie avec une résolution de 40 nm, c’est ce que permettent ces techniques avancées, qui ont valu le prix Nobel de Chimie 2014 à ses inventeurs.
