Agroécologie Temps de lecture 3 min
Comprendre la dissémination du virus de l’influenza aviaire pour renforcer la prévention
En déterminant comment s’est disséminé le virus de l’influenza aviaire hautement pathogène, les chercheurs du laboratoire Interactions Hôtes Agents Pathogènes (INRAE-ENVT) ont élaboré des cartes de risques afin d’optimiser la surveillance et la prévention dans les zones à risques.
Publié le 28 novembre 2019

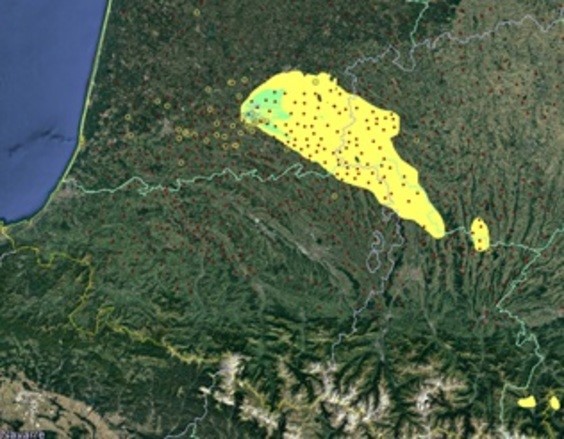
Pendant l’hiver 2016-2017, l’influenza aviaire hautement pathogène a sévi, surtout dans le sud-ouest de la France. Cette épizootie sans précédent était due au virus H5N8, introduit en Europe par des oiseaux sauvages migrateurs. 484 foyers ont été détectés, pour 80% des cas dans des élevages de palmipèdes. Pour comprendre comment ce virus hautement pathogène s’est propagé, des équipes du laboratoire Interactions Hôtes Agents Pathogènes (IHAP) d’INRAE Occitanie-Toulouse et de l’Ecole Nationale Vétérinaire de Toulouse (ENVT) ont analysé la distribution, dans le temps et l’espace, de ces foyers. L’épizootie s’est propagée en deux phases. Le virus s’est d’abord disséminé de proche en proche à une vitesse homogène d’environ 5km par semaine. « Entre novembre 2016 et fin janvier 2017, la probabilité d’apparition de nouveaux foyers était plus forte dans une fenêtre de 13 jours et de 8km autour des foyers existants », souligne Mathilde Paul, chercheuse de l’unité IHAP. Puis, à partir de février 2017, le virus s’est diffusé plus vite et sur de plus longues distances. « Dans cette 2e phase, la vitesse de propagation de la maladie a augmenté, note la chercheuse. Elle a dépassé les 10 km par semaine, dans le département des Landes ». Pendant cette phase d’accélération de l’épidémie, la diffusion par l’air du virus n’explique pas tous les foyers. Si elles ont réduit la diffusion locale du virus, les mesures d’abattage obligatoire n’ont pas permis d’endiguer des phénomènes de propagation à plus long distance.
Plusieurs facteurs de propagation
Une des hypothèses pour expliquer cette accélération de la propagation est un transport passif de particules virales par les vents dominants. « Début février 2017, trois tempêtes ont balayé le sud-ouest de la France. Cela correspond à la période à laquelle nous avons observé une vitesse de propagation plus rapide », partage Mathilde Paul. En s’appuyant sur un modèle de dispersion des particules développé par Météo-France, adapté aux particularités de ce virus, les chercheurs ont vu que la dispersion par voie aérienne ne suffisait pas à expliquer tous les nouveaux foyers. Il semblerait que les mouvements de palmipèdes gras aient un rôle clé dans cette diffusion. Pour le limiter, la biosécurité des transports a été considérablement renforcée. Mais ça reste un maillon à sécuriser pour protéger sanitairement les élevages.
Grâce à ces travaux, des cartes ont permis d’identifier des points communs aux situations à fort risque d’infection, comme le type d’exploitations, la présence de zones humides pouvant servir de refuges aux oiseaux sauvages.
Des travaux se poursuivent autour de l’analyse des mouvements de palmipèdes gras, pour les décrire et évaluer si la distribution des élevages infectés par le virus H5N8 est liée ou non à ces mouvements. Mieux cerner les risques liés au transport permettra, si besoin, de renforcer les mesures de prévention.
En savoir plus
Guinat C., Nicolas G., Vergne T. et al. Spatio-temporal patterns of highly pathogenic avian influenza virus subtype H5N8 spread, France, 2016 to 2017. Euro Surveill. 2018;23(26):pii=1700791. https://doi.org/10.2807/1560-7917.ES.2018.23.26.1700791
Guinat C., Rouchy N., Camy F. et al. Exploring the wind-borne spread of Highly Pathogenic Avian Influenza H5N8 during the 2016-2017 epidemic in France. Avian Diseases, Avian Dis. 2019 Mar 1;63(sp1):246-248. doi: 10.1637/11881-042718-ResNote.1.
