Alimentation, santé globale Temps de lecture 7 min
Biofilms : Les microbes en société
Publié le 17 avril 2024
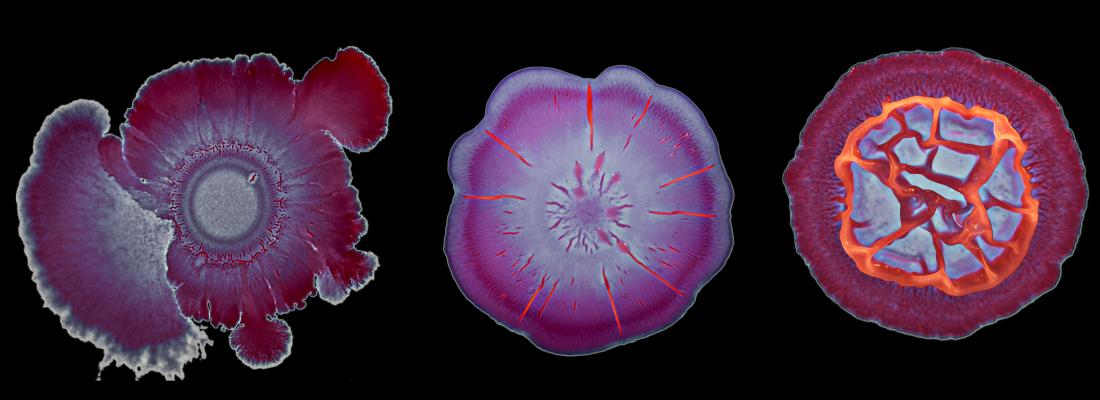
Les biofilms
Les microorganismes, y compris les bactéries, les champignons, les algues microscopiques et les virus, sont omniprésents dans notre environnement. Ils ont colonisé pratiquement tous les habitats disponibles sur Terre, qu’ils soient terrestres ou aquatiques, et se retrouvent même dans l’espace, à bord de la Station Spatiale Internationale.
La présence étendue des microorganismes sur Terre s'explique par leur remarquable capacité d'adaptation à des milieux très variés, y compris extrêmes. Une de leurs stratégies d'adaptation la plus cruciale est leur tendance à former des communautés organisées, appelées biofilms, où 40 à 80 % des microorganismes choisissent de coexister.
Les biofilms sont constitués de couches de cellules enveloppées dans une matrice complexe de sucres (polysaccharides), d'ADN et de protéines issues des microorganismes eux-mêmes. Cette matrice offre un refuge contre les stress environnementaux et les agents toxiques, procurant ainsi un habitat protecteur à ses résidents.
Ces structures sont le fruit d'une collaboration étroite entre les microorganismes qui les composent. Ils peuvent adopter diverses formes, chacune adaptée à son environnement spécifique. Au sein de ces structures, les microorganismes communiquent, se déplacent et se diversifient, illustrant la dynamique complexe et adaptative des biofilms.

| 
|
| 
|
Exemple de différents types de biofilms : Stromatolithes issus de cyanobactéries en Australie, Source d'eau chaude du Grand prismatic spring au parc de Yellowstone, Biofilm sur boite de Petri et kombucha fermenté maison
Les biofilms donnent de la couleur aux fromages : Blanc pour la Camembert, Bleu pour le Bleu des Causses, Orange pour le Livarot
Les biofilms jouent un rôle clé dans l'aspect et la saveur des fromages : blanc pour le Camembert, bleu pour le Bleu des Causses, orange pour le Livarot. Capables d'adopter toutes les couleurs de l'arc-en-ciel, les biofilms produisent également des odeurs et des saveurs distinctives.
Ces communautés microbiennes sont omniprésentes, souvent à notre insu. On les trouve dans nos cuisines et salles de bain, sur nos dents et notre peau, mais aussi sur les galets des rivières, les dalles de nos terrasses, dans le sol des forêts et des jardins. Les biofilms sont également courants dans les milieux industriels, en particulier dans l'industrie agroalimentaire, où ils influencent de nombreux processus.
Les biofilms, ennemis ou alliés ?
L'Organisation Mondiale de la Santé (OMS) estime qu'annuellement, les aliments non sûrs sont responsables de 600 millions de cas de maladies d'origine alimentaire et de 420 000 décès dans le monde. Des recherches scientifiques récentes mettent en évidence les caractéristiques émergentes des agents microbiens pathogènes au sein de communautés spatialement organisées, remettant en question l'efficacité de certaines méthodes de contrôle habituellement appliquées dans la chaîne. La matrice extracellulaire protectrice des biofilms, la diversification des types cellulaires, et leur comportement variable, leur confèrent une résistance accrue face aux désinfectants, aux conservateurs et au stress digestif post-ingestion. De plus, les biofilms sont impliqués dans l'émergence et la propagation de bactéries résistantes aux antibiotiques dans l'industrie alimentaire.
Pour comprendre ces propriétés uniques et développer des méthodes de contrôle efficaces, l'équipe de recherche INRAE B3D se penche sur la dynamique structurale, l'hétérogénéité phénotypique et les fonctions communautaires des biofilms. Utilisant les dernières avancées scientifiques, ces chercheurs élaborent des stratégies innovantes, en collaboration avec des partenaires académiques et industriels
Parmi ces nouvelles approches, l’exploitation de souches bénéfiques capables de former des biofilms protecteurs sur les surfaces critiques est en cours d’exploration dans divers secteurs pour prévenir l’implantation de microorganismes indésirables. Ces travaux interdisciplinaires, qui mêlent microbiologie, biologie moléculaire et imagerie, dépassent le domaine de l’alimentation, apportant des contributions significatives aux secteurs médical, biotechnologique et spatial, où les processus biologiques en jeu présentent des similitudes.
Exemples de PROJETS et COLLABORATIONS de l'équipe B3D
Ferments du Futur
Le 4 août 2022, la Première Ministre Élisabeth Borne annonçait le financement du Grand Défi France 2030 « Ferments du Futur » pour accélérer la recherche et l’innovation dans le domaine des ferments et des aliments fermentés. Ces derniers constituent des environnements complexes pour les micro-organismes, caractérisés par des structures spatiales hétérogènes qui se transforment au cours de la fermentation. Afin de décrypter les interactions microbiennes et les fonctions émergentes associées dans ces systèmes, le plateau technique PIAM de la plateforme distribuée « Ferments du Futur », installé à Micalis, est en pleine phase de développement au sein de Micalis. Cette infrastructure permettra l'étude précise des interactions microbiennes, rendant possible la modélisation et l'analyse détaillée des écosystèmes microbiens dans les aliments fermentés.
Aller plus loin : Ferments du futur
Les biofilms et l’espace
Des biofilms dans la station spatiale internationale
En 2020, suite à l'organisation par l'INRAE du séminaire interne « Objectif Lune » et à la publication d'articles mettant en lumière l’importance des biofilms microbiens dans les missions spatiales, des scientifiques de l'équipe B3D ont été invités par l'Agence Spatiale Européenne (ESA) à rejoindre un groupe d'experts dédié. Avec l'augmentation de la durée des missions des astronautes dans des environnements spatiaux confinés, tels que la Station Spatiale Internationale (ISS), et les projets futurs d'habitation humaine sur la Lune et Mars, la question des biofilms devient cruciale. Ces habitats spatiaux peuvent être colonisés par des micro-organismes en forme de biofilms, menaçant ainsi le fonctionnement optimal des équipements et la santé des astronautes. Dans le cadre d'une thèse financée par l'ESA, nous étudions les effets de la microgravité et de l'hypergravité simulées sur l'adaptabilité des bactéries au sein des biofilms, ainsi que les mécanismes d'installation et de dissémination de ces communautés microbiennes dans ces milieux particuliers. L'équipe B3D contribue également au programme Erasmus+ « Space Edu », qui vise à stimuler l'innovation dans le secteur des technologies spatiales.
Aller plus loin : Space Edu - Online Educational Platform, École d’été "Space Technology 4 all" : quand la microbiologie et le droit s’invitent dans les sciences de l’espace
Les derniers résultats de l’équipe B3P publiés dans la revue Nature Communications
Bacillus subtilis peut former divers types de communautés organisées spatialement sur les surfaces, telles que des colonies, des pellicules et des biofilms immergés. Ces communautés présentent des similitudes et des différences, et une hétérogénéité phénotypique a été signalée pour chaque type de communauté.
Dans cette étude, les chercheurs ont étudié l'hétérogénéité de l’expression des gènes à travers trois types de communautés de B. subtilis cultivées sur différents milieux (liquide, agar dur ou mou). En analysant la variation d’expressions des ARN des bactéries dans différentes régions des biofilms, ils ont pu identifier les gènes spécifiquement exprimés dans chaque sous-population sélectionnée.
L'utilisation de constructions génétiques fluorescentes a permis l'observation en temps réel et à l’échelle de la cellule unique, de l'expression des gènes d'intérêt au sein de différents biofilms, grâce à la microscopie confocale à balayage laser. Cette méthode a facilité la visualisation précise et dynamique des processus biologiques en cours.
Des schémas d'expression démontrant une dynamique localisée pour certains gènes ont été mis en évidence. Notamment, une analyse au sein d’un même biofilm a révélé une distribution spatiale spécifique des gènes impliqués dans les voies métaboliques glycolytiques et gluconéogéniques. Ceci suggère l'existence de sous-populations bactériennes qui adaptent la régulation de leur métabolisme du carbone en fonction de leur environnement micro-local.


Pour aller plus loin : un livre accessible à tous paru au éditions Quae Biofilms : La vie des microbes en société
La forme d'organisation dominante dans le monde microbien est le biofilm, une structure communautaire organisée en trois dimensions. Présents partout, tant dans nos environnements naturels qu’anthropisés — salles de bain, cuisines, lieux de travail, moyens de transport, hôpitaux — et même au sein de notre propre corps, les biofilms peuvent être bénéfiques, nuisibles, voire dangereux. Dans un style clair et évocateur, les auteurs révèlent comment les microbes, en communiquant entre eux et en échangeant des gènes, s'adaptent aux dynamiques d'une microsociété en constante évolution. Ils acquièrent ainsi des capacités remarquables de colonisation et de résistance, caractéristiques des biofilms. Auteurs : Romain Briandet Chercheur INRAE, Murielle Naïtali Maître de conférence Agro Paris Tech, Couverture : Colony, huile sur toile de l'artiste Teppei Ikehila
Bibliographie de l'équipe B3D
- Direct comparison of spatial transcriptional heterogeneity across diverse Bacillus subtilis biofilm communities. Dergham Y, Le Coq D, Nicolas P, Bidnenko E, Dérozier S, Deforet M, Huillet E, Sanchez-Vizuete P, Deschamps J, Hamze K, Briandet R. Nat Commun. 2023 Nov 20;14(1):7546. doi: 10.1038/s41467-023-43386-w.
- Bacillus subtilis NDmed, a model strain for biofilm genetic studies. Yasmine Dergham, Dominique Le Coq, Arnaud Bridier, Pilar Sanchez-Vizuete, Hadi Jbara, Julien Deschamps, Kassem Hamze, Ken-ichi Yoshida, Marie-Françoise Noirot-Gros, Romain Briandet. Biofilm 6 (2023) 100152.
- Spatially localised expression of the glutamate decarboxylase gadB in Escherichia coli O157:H7 microcolonies in hydrogel matrices. Cédric Saint Martin, Nelly Caccia, Maud Darsonval, Marina Gregoire, Arthur Combeau, Grégory Jubelin, Florence Dubois-Brissonnet, Sabine Leroy, Romain Briandet and Mickaël Desvaux. npj Sci Food 7, 55 (2023).
- Positive biofilms to guide surface microbial ecology in livestock buildings. Virgile Gueneau, Julia Plateau-Gonthier, Ludovic Arnaud, Jean-Christophe Piard, Mathieu Castex, Romain Briandet. Biofilm 4 (2022) 100075.
- `Migration of surface-associated microbial communities in spaceflight habitats. Daniele Marra, Thodoris Karapantsios, Sergio Caserta, Eleonora Secchi, Malgorzata Holynska, Simon Labarthe, Bastien Polizzi, Sandra Ortega, Margaritis Kostoglou, Christophe Lasseur, Ioannis Karapanagiotis, Sigolene Lecuyer, Arnaud Bridier, Marie-Françoise Noirot-Gros, Romain Briandet. Biofilm 5 (2023) 100109.
