Alimentation, santé globale Temps de lecture 4 min
Le microbiote intestinal : un rôle central dans la physiopathologie de la myopathie de Duchenne
Publié le 11 juin 2024
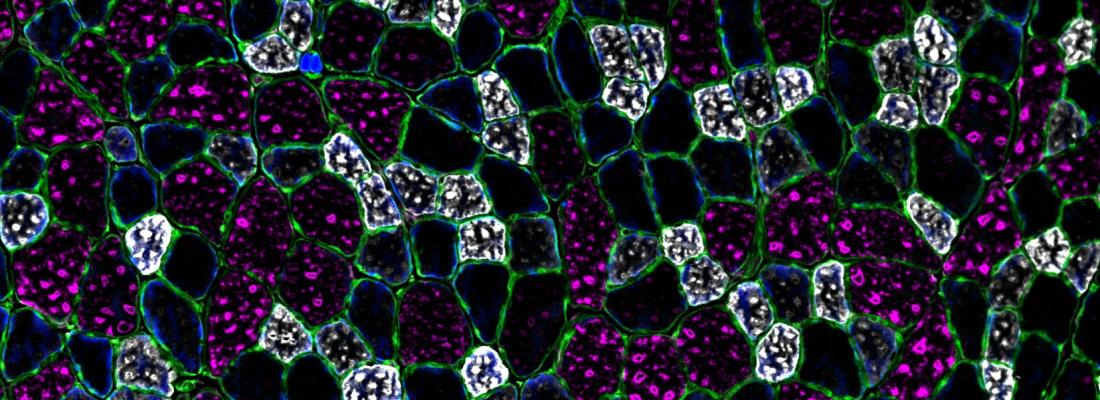
Maladie progressive dégénérative, la dystrophie musculaire de Duchenne (DMD) est l’une des myopathies génétiques les plus fréquentes (6 cas pour 100 000 individus) qui affecte la structure et la fonction des muscles squelettiques, en raison de l’altération de synthèse de la protéine dystrophine. La DMD évolue jusqu´à atteindre les muscles respiratoires et cardiaque, provoquant le décès prématuré des individus atteints. De surcroit, les patients touchés par la DMD présentent des troubles gastro-intestinaux sévères. Au-delà des thérapies visant à restaurer l’expression de dystrophine (maladie primaire), il est essentiel également de prendre en charge la physiopathologie DMD dans sa globalité. Or, le microbiote intestinal est un organe clé dans la santé de l’hôte impactant le fonctionnement d’autres organes notamment via des métabolites dérivés des bactéries. Il apparaissait donc comme une cible potentielle de la DMD pouvant contribuer à sa physiopathologie, notamment sur les aspects musculaires depuis la mise en évidence d’un axe microbiote-muscle dans d’autres contextes de recherche.
Les résultats de cette étude révèlent effectivement une signature bactérienne singulière chez la souris mdx, modèle murin de la DMD, caractérisée par un appauvrissement en diversité et une composition spécifique (dysbiose). Les phyla Actinobacteria, Proteobacteria et Tenericutes sont sous-representés et le phylum Déferibacteres apparait comme spécifique et les bactéries gram-négatives sont surreprésentées. Ce microbiote dysbiotique s’accompagne d’une altération de la barrière intestinale avec un péristaltisme ralenti et une inflammation connexe de bas grade, s’ajoutant à la détérioration de la fonction du muscle squelettique. La découverte d’un phénotype microbiotique spécifique associé à une fonction intestinale et musculaire dégradée et une inflammation systémique de bas grade ouvre des perspectives nouvelles.
L’intégration du microbiote intestinal dans l’équation de la physiopathologie de la DMD renforce l’approche holistique de prise en charge de cette maladie. Les implications cliniques sont particulièrement prometteuses car cette étude élargit le spectre des options thérapeutiques, au-delà des traitements classiques ciblés sur la dystrophine au niveau musculaire, encourageant le développement conjoint de stratégies nutritionnelles personnalisées innovantes, en lien avec les bactéries intestinales.
Référence : https://doi.org/10.1016/j.ajpath.2023.10.010
