Mettre des cellules végétales en boîte pour analyser le comportement du cytosquelette
Publié le 28 décembre 2020
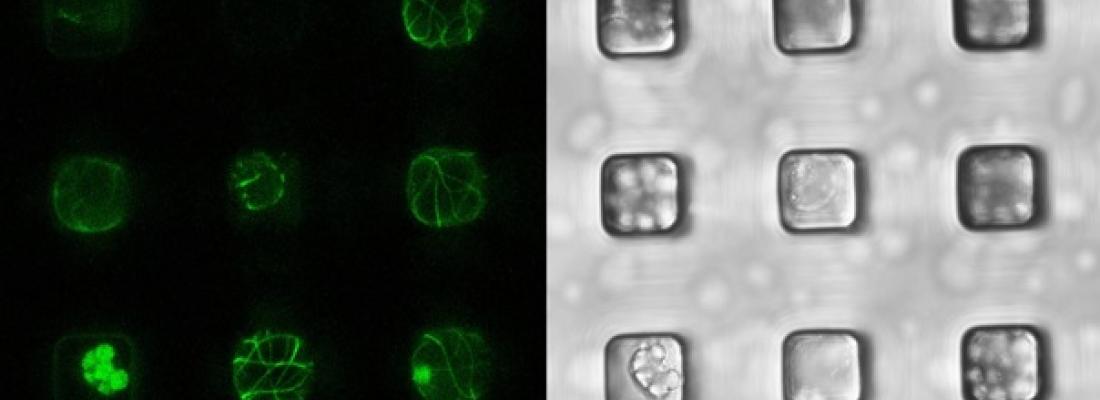
La forme des cellules et tissus végétaux dépend principalement des fibres de cellulose, dont le dépôt est contrôlé par des structures filamentaires intracellulaires, les microtubules. Cependant, le processus qui oriente les microtubules est toujours débattu. Ici, nous avons utilisé la microfabrication pour confiner et déformer de manière contrôlée les cellules végétales sans paroi. Cela nous permet d'analyser comment la géométrie des cellules peut contrôler le comportement des microtubules. Nous démontrons que les microtubules s'alignent le long du grand axe des cellules par défaut, et au contraire le long du petit axe de la cellule lorsque la pression de turgescence augmente. Cela explique de nombreuses observations dans les tissus végétaux, notamment la réorientation des microtubules (et de la cellulose) de transverse à longitudinal quand la croissance s’arrête. Cela fournit également un mécanisme simple au cœur de la forme des plantes : les microtubules s'alignent spontanément avec la tension, dans un système auto-organisé typique qui permet d’aligner la fibres rigides de cellulose le long des contraintes maximales. En d’autres termes, notre système expérimental simplifié et les résultats associés montrent comment les cellules végétales sont capables de percevoir les forces et d’y résister.
Abstract
In plant cells, cortical microtubules (CMTs) generally control morphogenesis by guiding cellulose synthesis. CMT alignment has been proposed to depend on geometrical cues, with microtubules aligning with the cell long axis in silico and in vitro. Yet, CMTs are usually transverse in vivo, i.e., along predicted maximal tension, which is transverse for cylindrical pressurized vessels. Here, we adapted a microwell setup to test these predictions in a single-cell system. We confined protoplasts laterally to impose a curvature ratio and modulated pressurization through osmotic changes. We find that CMTs can be longitudinal or transverse in wallless protoplasts and that the switch in CMT orientation depends on pressurization. In particular, longitudinal CMTs become transverse when cortical tension increases. This explains the dual behavior of CMTs in planta: CMTs become longitudinal when stress levels become low, while stable transverse CMT alignments in tissues result from their autonomous response to tensile stress fluctuations.
