Alimentation, santé globale Temps de lecture 2 min
Perturber la communication entre les cellules pour inhiber la virulence de la bactérie Bacillus cereus
Publié le 14 août 2018
Chez les bactéries Gram+, certaines fonctions sont régulées par des systèmes de communication intercellulaires appelés quorum sensing. Chez la bactérie pathogène Bacillus cereus, responsable d’intoxications alimentaires chez l’homme, mais aussi d’infections nosocomiales chez des individus affaiblis, le système PlcR-PapR contrôle la transcription des principaux gènes de virulence. Dans ce système, PapR est le peptide de signalisation et PlcR est le régulateur transcriptionnel. C’est ce processus clé du pouvoir pathogène de B. cereus que des chercheurs de l’Inra et leurs collègues israéliens de l’Université hébraïque de Jérusalem, ont exploré plus avant.
Communiquer entre bactéries, du quorum sensing au quorum quenching
Depuis plusieurs années, nous savons que les bactéries sont capables de communiquer entre elles et de changer leur comportement en fonction de leur densité cellulaire grâce à un processus appelé quorum sensing ou QS. Cette communication intercellulaire repose sur des signaux chimiques que les bactéries synthétisent et secrètent dans le milieu extérieur et qui sont reconnus par les bactéries avoisinantes. Ceci conduit à une réponse synchronisée de la communauté par le biais de mécanismes génétiques de régulation. L’expression de facteurs de virulence, la sporulation, la production d'antifongiques ou d'antibiotiques, l'organisation en biofilm sont quelques-unes des fonctions régulées par QS.
L'action de ces signaux et les fonctions contrôlées par QS peuvent être atténuées ou abolies en interférant avec les molécules de signalisation (dégradation, blocage…). On parlera alors de quorum quenching.
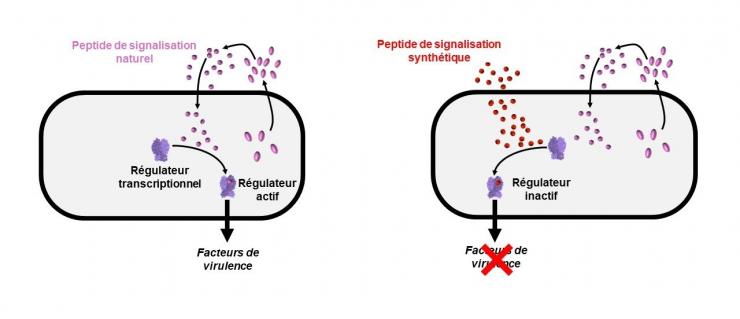
Alliant des techniques de biochimie et de génétique, les scientifiques ont élaboré des peptides synthétiques dérivés du peptide de signalisation PapR et mis en évidence la capacité de certains d’entre eux à inhiber le système PlcR-PapR de B. cereus et donc la production de facteurs de virulence par cette bactérie pathogène.
Ces peptides synthétiques n’affectent pas la croissance bactérienne mais bloquent l’activité régulatrice de PlcR quand ils sont utilisés précocement au cours de la croissance. Cette inhibition n’est pas levée par le peptide endogène de signalisation PapR. Ceci indique que ces peptides ont une action prolongée lors de la croissance de B. cereus.
Ces peptides sont les premiers inhibiteurs du système de quorum sensing chez B. cereus qui n’aient jamais été proposés. Leur conception et la démonstration de leur fonction antagoniste constituent une preuve de concept et une étape clé dans la mise en évidence et la caractérisation des systèmes bactériens de communication intercellulaires, domaine dans lequel ces mêmes chercheurs Inra sont leaders depuis de nombreuses années, en collaboration avec des partenaires nationaux et internationaux. Ils ouvrent des perspectives pour développer des stratégies médicales novatrices autour du quorum quenching qui réduisent ou abolissent la virulence des bactéries plutôt que de tenter d’éliminer celles-ci à l’aide d’antibiotiques, bactéricides ou bactériostatiques, au risque de sélectionner des microorganismes résistants.
Référence
Avishag Yehuda, Leyla Slamti, Racheli Bochnik-Tamir, Einav Malach, Didier Lereclus and Zvi Hayouka Turning off Bacillus cereus quorum sensing system with peptidic analogs Chemical Communications, 2018 DOI: 10.1039/C8CC05496G
