Alimentation, santé globale Temps de lecture 3 min
De l’oxygène pour lutter contre une toxine intestinale
Publié le 28 novembre 2023
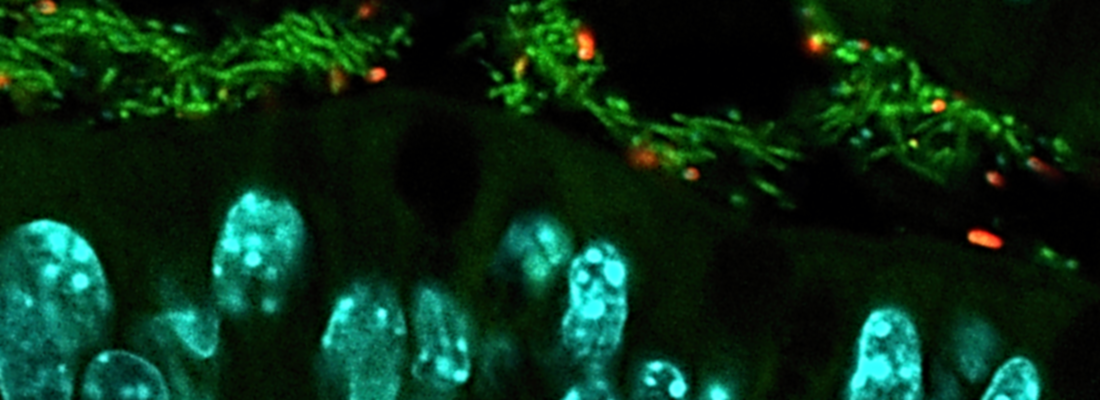
La colibactine, une toxine produite par la bactérie Escherichia coli
Les bactéries Escherichia coli (E. coli) résident dans le tube digestif des animaux à sang chaud, dont les humains. La majorité des souches présentes sont inoffensives, cependant, certaines sont pathogènes. Ainsi, jusqu’à 25% des souches isolées dans les selles d’humains en bonne santé abritent un ensemble de gènes, appelé îlot pks, qui conduit à la synthèse de la colibactine.
Cette dernière est hautement nocive pour les cellules car elle induit des lésions de l’ADN. On parle alors d’effets génotoxiques, lorsque les dommages causés à l’ADN ne sont pas correctement réparés et conduisent à l’apparition de mutations, qui peuvent avoir des effets plus ou moins délétères. Dans le cas de la colibactine, les lésions peuvent conduire à un arrêt de la division cellulaire.
Cette toxine est donc dangereuse pour les cellules hôtes, en l’occurrence celles de l’intestin chez les animaux, dont l’humain. Elle est aussi capable d’affecter la bactérie qui la produit. C’est pour cela que l’îlot pks se dote également d’un système d’autoprotection.
Depuis plusieurs années maintenant, on suppose très fortement que les mutations induites par la colibactine jouent un rôle important dans l’apparition du cancer colorectal. Or, ce dernier s’impose, en France, chez les non-fumeurs, comme la première cause de décès par cancer chez les moins de 65 ans.
Déterminer un moyen de lutter contre la colibactine serait donc bénéfique pour les différentes affections survenant dans l’intestin, y compris contre les tumeurs. Or, il s’avère que la colibactine est particulièrement sensible à la concentration en oxygène.
Une toxine inhibée par l’oxygène
De précédentes études ont montré que la colibactine était fortement régulée par les conditions environnementales dans lesquelles elle était produite. Plus précisément, ces conditions sont celles de l’intestin dans lequel les bactéries pks+ E. coli relâchent la colibactine.
Ainsi, la colibactine est sensible à la disponibilité du fer, à la quantité de carbone ou encore à la présence de sucres. En somme, la toxine est sensible au régime alimentaire de l’hôte. Mais pas seulement ! L’oxygène a également un rôle à jouer…
L’oxygène est un facteur environnemental clé, qui occupe une place centrale dans les mécanismes métaboliques de l’hôte et de la bactérie.
L’intestin se caractérise par un profil d’oxygénation unique, avec un gradient bien marqué dans la concentration en oxygène. La paroi présente une très faible concentration en oxygène, tandis que le centre de l’intestin présente un milieu anaérobie, donc totalement dénué d’oxygène. Un tel environnement favorise le développement des bactéries anaérobies, dont certaines souches de E.coli.
Jusqu’à présent, l’impact de l’oxygène sur la colibactine n’avait pas été étudié. Grâce à ces nouveaux travaux, les scientifiques de l’IRSD ont pu montrer que la toxine y est pourtant très sensible. Sa production est ainsi maximale dans des conditions anoxiques, dépourvues d’oxygène, et elle va diminuer au fur et à mesure que la concentration en oxygène augmente. Plus il y a d’oxygène dans le milieu, plus la génotoxicité de la colibactine est donc atténuée. Ceci indique que l’îlot pks et sa voie de biosynthèse fonctionnent uniquement dans des conditions dépourvues d’oxygène.
De tels résultats laissent la porte ouverte à l’utilisation potentielle de l’oxygène pour lutter contre la colibactine et ses effets nocifs sur les organismes.
Référence :
Bossuet N, Guyonnet C, Chagneau CV, Tang-Fichaux M, Penary M, Loubet D, Branchu P, Oswald E, Nougayrede JP. Oxygen concentration modulates colibactin production. Gut Microbes. 2023 Jan-Dec;15(1):2222437. doi: 10.1080/19490976.2023.2222437
