Alimentation, santé globale Temps de lecture 2 min
L’origine de l’encéphalopathie spongiforme bovine identifiée ?
Publié le 17 décembre 2019
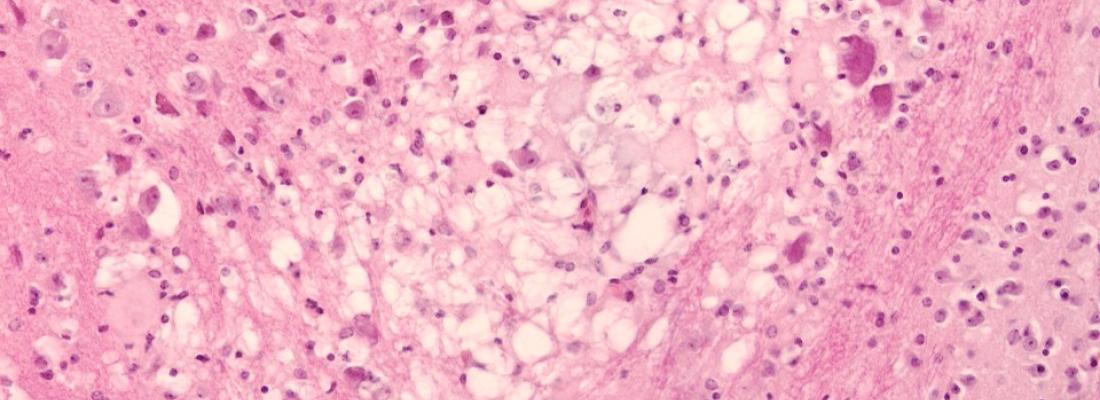
La tremblante atypique (AS pour atypical scrapie) est une forme de maladie à prion qui affecte les petits ruminants (ovins, caprins). Identifiée seulement en 1998, cette forme de tremblante circule depuis au moins 50 ans dans les populations de petits ruminants. Elle affecte l’ensemble des pays où des ovins et des caprins sont élevés et il n’existe actuellement aucune mesure efficace de contrôle ou de prévention de cette maladie. La transmissibilité de l’AS aux autres espèces (y compris l’homme) demeure très peu documentée.
Dans le cadre d’une collaboration européenne, des chercheurs de l’Inra et de l’ENVT ont montré que le prion responsable de l’AS avait la capacité à franchir la barrière d’espèce qui limite naturellement sa propagation aux bovins. De manière inattendue, la transmission d’isolats d’AS à des souris transgéniques exprimant la protéine prion bovine entraîne la propagation de l’agent responsable de l’Encéphalopathie Spongiforme Bovine (ESB) classique. Ces résultats s’expliquent par la présence de faibles quantités d’ESB classique dans les isolats d’AS. Ces particules d’ESB classique semblent spontanément produites lors du processus de réplication de l’AS chez ses hôtes naturels.
Pour la première fois, ces données apportent une explication expérimentalement étayée à l’apparition au milieu des années 80 de l’ESB classique chez les bovins au Royaume Uni, avant qu’une épidémie de cette maladie ne s’étende à toute l’Europe, l’Amérique du Nord et de nombreux autres pays. L’exposition de consommateurs à des produits issus de bovins infectés par l’ESB classique a été à l’origine de l’émergence du variant de la maladie de Creutzfeldt Jakob.
En Europe, les mesures prises par les autorités sanitaires dès le début des années 90 ont permis de maîtriser efficacement les risques associés à l’épidémie de l’ESB classique (y compris les risques zoonotiques). Aujourd’hui, malgré le coût économique de ces mesures et la quasi disparition des cas d’ESB, le risque de voir ré-émerger l’ESB à partir de cas de tremblante atypique des petits ruminants plaide pour un maintien des mesures les plus fondamentales (interdiction des farines animales, élimination et destruction systématiques des tissus à risque le plus élevé…) qui ont permis ces 20 dernières années de protéger les consommateurs et les filières de production de la maladie de la « vache folle ».
|
Les maladies à prion sont des maladies neurodégénératives provoquant des troubles neurologiques progressifs d’issue fatale, après une période d’incubation longue et silencieuse. Elles touchent l’Homme (maladie de Creutzfeldt-Jakob, insomnie fatale familiale), les animaux d’élevage (maladie de la vache folle, tremblante du mouton et de la chèvre, maladie à prion du dromadaire) et les animaux sauvages (maladie du dépérissement chronique des cervidés). Les symptômes peuvent être d’ordres locomoteurs, sensoriels et comportementaux. Contrairement aux virus, les bactéries ou des parasites, un prion ne dispose pas d’acide nucléique (ADN ou ARN) comme matrice de l’information infectieuse. L’agent responsable est composé exclusivement de particules protéiques. Chaque protéine du prion existe sous deux formes : une forme normale associée à des fonctions biologiques, et une forme mal repliée qui est à l’origine de la maladie. |
|
Publication The emergence of classical BSE from atypical/Nor98 scrapie. Alvina Huor et al. PNAS first published December 16, 2019 https://doi.org/10.1073/pnas.1915737116 |
