Agroécologie Temps de lecture 4 min
Comment voulez-vous votre méiose : avec ou sans crossing-over ?
Publié le 17 mars 2016

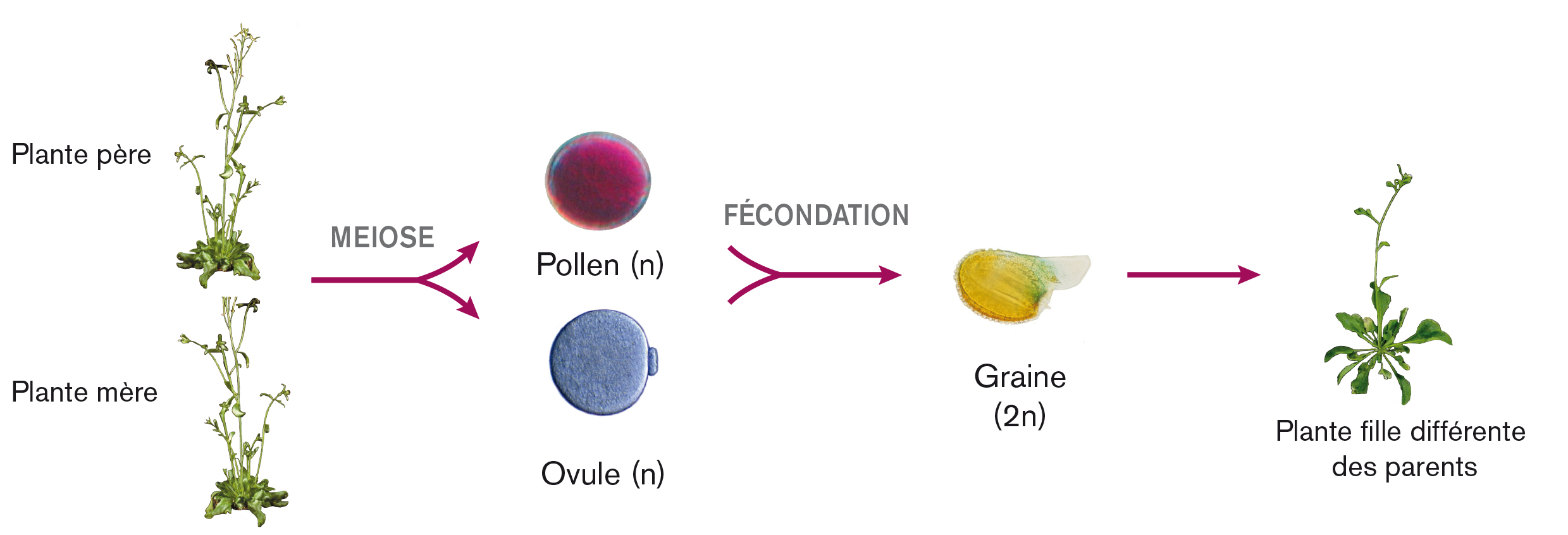
Chez les espèces à reproduction sexuée, les descendants sont uniques. Ils sont différents des parents puisqu’ils contiennent du matériel génétique provenant des deux parents. Mais ils sont aussi différents entre eux. Ce deuxième niveau de diversité génétique est lié au processus de la méiose, une forme de division spéciale qui génère les cellules reproductrices à partir des cellules parentales mâle et femelle. Au cours de la méiose, les chromosomes de la cellule parentale, organisés en paires (1), sont séparés et distribués dans deux, puis quatre cellules filles. Mais avant d’être séparés, les chromosomes des paires, qui sont dits « homologues », peuvent échanger entre eux du matériel génétique, par le mécanisme de crossing-over. L’équipe de Raphael Mercier travaille depuis 2003 sur ces processus de méiose et de crossing-over qui sont essentiels pour générer de la diversité génétique au sein des espèces.
Quelle est la fonction des crossing-over ?
Raphaël Mercier : Les crossing-over ont deux grandes fonctions. La première est d’augmenter le niveau de brassage génétique. La deuxième est d’assurer une distribution équitable des chromosomes parentaux dans les cellules filles. En effet, les crossing-over maintiennent les chromosomes homologues ensemble, ce qui permet de les positionner correctement sur le fuseau de fibres qui va ensuite les séparer et les répartir équitablement entre les deux cellules filles (2). Sans cette étape, les chromosomes seraient distribués n’importe comment. C’est le cas par exemple dans la trisomie 21 chez les humains : en l’absence de crossing-over, les deux chromosomes homologues de la paire n°21 vont dans le même ovule au lieu d’être séparés, ce qui donne, après fécondation par un spermatozoïde, un embryon anormal avec trois chromosomes 21 au lieu de deux (3).
Le rôle des crossing-over est donc très important. Pour autant, point trop n’en faut ! Il y a en moyenne deux à trois crossing-over seulement par chromosome et par méiose, toutes espèces confondues (4). Ce nombre de crossing-over est très stable, très contrôlé, grâce à plusieurs mécanismes moléculaires qui limitent le nombre de crossing-over.
Diaporama : les étapes de la méiose et le rôle des crossing-over dans la répartition des chromosomes homologues entre les cellules filles :
Pourquoi si peu de crossing-over ?
R. M. :On peut avancer deux hypothèses. La première est d’ordre mécanique : trop de crossing-over empêcherait les chromosomes homologues de bien se séparer. Nos travaux tendent à infirmer cette hypothèse puisque nous avons obtenu des mutants ayant 9 fois plus de crossing-over et chez lesquels la méiose se fait correctement (5). La deuxième hypothèse est d’ordre génétique : trop de crossing-over pourrait « rebrasser » des combinaisons de gènes favorables établies au cours de l’évolution, ce qui aurait un « coût » à long terme pour l’expansion de l’espèce.
Pourquoi chercher à augmenter le nombre de crossing-over ?
R. M. :Augmenter le nombre de crossing-over peut permettre d’accélérer le brassage génétique et d’obtenir plus de nouvelles combinaisons de gènes, ce qui est très intéressant pour les programmes de sélection. De fait, nous avons pu, chez Arabidopsis thaliana (6), augmenter le nombre de crossing-over d’un facteur 9 sans perturber la méiose. Nous avons pour cela inhibé des gènes « anti -crossing-over » par des mutations ciblées. Nous sommes, en collaboration avec d’autres équipes de l’Inra, en train de tester ces mutations sur d’autres espèces, pois tomate, colza. L’avènement des méthodes d’édition des génomes (7) permet d’envisager l’application de cette technique chez de nombreuses espèces.
(1) Chez la plupart des espèces, les chromosomes sont organisés en paire (2n). L’homme possède 23 paires de chromosomes, la plante modèle Arabidopsis thaliana en possède cinq.
(2) Voir le diaporama.
(3) Les anomalies de nombre de chromosome (aneuploïdies) sont responsables de 30 à 40 % des avortements spontanés. Leur fréquence est donc plus importante qu’il n’y paraît.
(4) Avec des exceptions : l’abeille, par exemple, a une fréquence de crossing-over plus élevée. C’est aussi le cas d’une levure, Schizosaccharomyces pombe, qui a une moyenne de quinze crossing-over par chromosome et par méiose.
(5) Voir encadré 1.
(6) Arabidopsis thaliana : modèle de plante à fleur, famille des crucifères.
(7) Méthode de mutagénèse ciblée Cas9-CrisprR. Pour en savoir plus sur ces méthodes récentes.
Pour qu’il y ait crossing-over, c’est-à-dire échange de fragments d’ADN entre deux chromosomes, il faut d’abord qu’il y ait une cassure du double brin d’ADN. Cette cassure déclenche des mécanismes de réparation, dont la plupart se font sans crossing-over : le brin se ressoude à l’identique. C’est ainsi que le nombre de cassures est beaucoup plus élevé que le nombre de crossing-over (25 fois plus chez Arabidopsis).
L’équipe de Raphaël Mercier a identifié trois gènes impliqués dans la limitation du nombre de crossing-over chez l’espèce modèle Arabidopsis thaliana. Ces gènes sont très conservés dans le règne vivant. Deux d’entre eux, fancm et recq4, codent pour des hélicases, et ont un rôle plus général dans la réparation de l’ADN. Ils sont associés à deux maladies génétiques, respectivement l’anémie de Fanconi et le syndrome de Bloom. Le troisième, figl1, est aussi conservé chez l’homme, et sa fonction est la régulation des premières étapes de la réparation de l’ADN.
Une double mutation des gènes fancm et recq4 augmente la fréquence des crossing-over d’un facteur 9.
Références :
- Gène fancm (hélicase) :
Crismani et al. 2012. Science 336: 1588–1590. DOI: 10.1126/science.1220381.
- Gène recq4 (hélicase) :
Wu et al. 2003. Nature 426 (6968):870–874. DOI: 10.1038/nature02253.
- Double mutation des gènes fancm et recq4
Séguéla-Arnaud et al. 2015. Proc Natl Acad Sci 112 (15):4713–4718. DOI: 10.1073/pnas.1423107112
- Gène Figl1 (ATPase FIDGETIN-LIKE-1) :
Girard et al. 2015. PLOS Genetics DOI: 10.1371/journal.pgen.1005369.
L’équipe de Raphaël Mercier travaille sur un autre grand axe, qui consiste cette fois à éliminer le brassage génétique lié à la reproduction sexuée et aux crossing-over : il s’agit d’obtenir des graines strictement identiques à la plante mère, mimant ainsi un phénomène naturel mais assez rare appelé apomixie. « Si nous arrivons à la fin du processus, indique Raphaël Mercier, c’est-à-dire si nous sommes capables d’avoir une plante qui se multiplie par graine en restant identique à elle-même, nous pouvons nous attendre à une véritable révolution dans le monde de la sélection végétale ! En particulier, la possibilité de reproduire des hybrides sans avoir à refaire le croisement à chaque fois permettrait de lever beaucoup de barrières et de produire de nombreux hybrides adaptés à toutes sortes de milieux plus rapidement et plus économiquement ». Pour l’instant, les chercheurs arrivent à produire des graines « clonales » avec une fréquence de 30 % chez Arabidopsis, et des travaux de transfert à des espèces cultivées sont en cours.
